Gestação e Lactância:
O clichê de que o “feto é o parasita perfeito” implica que os fetos
captem tudo que precisam à custa do hospedeiro. No entanto, em
algum momento a deficiência nutricional pode resultar em trabalho
de parto prematuro, aliviando o hospedeiro de uma dívida nutricional
em curso. Após o nascimento a nutrição de qualidade durante o
aleitamento continua o processo de fornecimento de blocos de
construção nutricionais para o desenvolvimento cerebral normal e o
crescimento de todos os órgãos do corpo do recém-nascido.
Este período — de crescimento de um novo ser humano —
configura o estágio para a saúde das futuras gerações. A qualidade e a
quantidade de alimento para o zigoto em desenvolvimento, depois
feto, recém-nascido e em seguida adulto, emergem como uma
explicação para as doenças que se manifestam na idade adulta.
Fertilidade: mulheres com um IMC menor que 20 kg/m2
têm um risco aumentado
de anovulação. Homens e mulheres apresentam taxas de infertilidade
aumentadas quando há excesso de massa corporal ou obesidade; a
perda de massa corporal e o aumento da atividade física podem ser
úteis (Simon, 2014).
FIM: pag 916
Pediatria:
A taxa de crescimento diminui consideravelmente após o primeiro
ano de vida. Os incrementos de mudança são pequenos comparados
com os da lactância e adolescência; a massa corporal normalmente
aumenta, em média, de 1,6 a 3,3 kg por ano até que a criança tenha 9
ou 10 anos de idade. Então a taxa aumenta, sinalizando a aproximação
da puberdade. Os incrementos de aumento da estatura são em média
de 5 a 9 cm por ano até o estirão de crescimento individual visto na
puberdade.
O crescimento é geralmente constante e lento durante os anos de
idade pré-escolar e escolar, mas pode ser errático em certas crianças,
com períodos de ausência de crescimento seguidos por estirões de
crescimento. Esses padrões geralmente são paralelos a mudanças
similares no apetite e ingestão de alimentos. Para os pais, os períodos
de crescimento lento e falta de apetite podem causar ansiedade,
levando a conflitos nos horários das refeições.
A composição corporal de crianças em idade pré-escolar e escolar
permanece relativamente constante. A gordura diminui gradualmente
durante os primeiros anos da infância, atingindo um mínimo entre 4 e
6 anos de idade. As crianças então passam pelo rebote de adiposidade,
ou aumento da gordura corporal em preparação para o estirão de
crescimento puberal. O rebote de adiposidade mais precoce foi
associado ao aumento do índice de massa corporal (IMC) adulto
(Williams e Goulding, 2009).
As diferenças entre os sexos na
composição corporal tornam-se cada vez mais evidentes: os meninos
têm mais massa corporal magra por centímetro de estatura do que as
meninas.
As medições de crescimento obtidas
em intervalos regulares fornecem informações sobre o padrão de
crescimento de um indivíduo. As medições de uma só vez não
permitem a interpretação do estado de crescimento. Os canais de
crescimento não são bem estabelecidos até após os 2 anos de idade. As
crianças geralmente mantêm as suas estaturas e as suas massas
corporais nos mesmos canais de crescimento durante os anos pré-escolares e da infância.
O monitoramento regular do crescimento possibilita que sejam
identificadas tendências problemáticas e que seja iniciada a
intervenção precoce para que o crescimento a longo prazo não seja
comprometido. A massa corporal que aumenta rapidamente e cruza
os canais de crescimento pode sugerir o desenvolvimento de
obesidade.
A falta de ganho de massa corporal em um
período de meses ou a perda de massa corporal pode ser resultado de
desnutrição, doença aguda, doença crônica não diagnosticada ou
problemas emocionais ou familiares significativos.
Uma criança que está se recuperando de uma doença ou desnutrição e
cujo crescimento ficou mais lento ou parou experimenta uma taxa de
recuperação maior do que a esperada. Esta recuperação é chamada de
recuperação do crescimento, um período durante o qual o corpo se
esforça para voltar ao canal de crescimento normal da criança.
Exigências nutricionais
Como as crianças estão crescendo e desenvolvendo ossos, dentes,
músculos e sangue, elas precisam de alimentos mais nutritivos em
proporção ao seu tamanho do que os adultos.
As proporções de
ingestão sugeridas de energia são de 45 a 65% como carboidratos, 30 a
40% como lipídeos e 5 a 20% como proteínas para crianças de 1 a 3
anos de idade, com os carboidratos na mesma proporção para crianças
de 4 a 18 anos de idade, 25 a 35% como lipídeos e 10 a 30% como
proteínas.
A necessidade de proteínas diminui de aproximadamente 1,1 g/kg na
primeira infância para 0,95 g/kg no final da infância.
Ferro
As crianças entre 1 e 3 anos de idade estão em risco de anemia por
deficiência de ferro, que pode afetar o desenvolvimento. O período de
crescimento rápido da lactância é marcado por um aumento nas
concentrações de hemoglobina e massa de ferro total. Crianças com alimentação por mamadeira prolongada
e os de ascendência mexicana americana estão em maior risco para a
deficiência de ferro (Moshfegh et al., 2005). As ingestões
recomendadas devem levar em consideração a taxa de absorção e a
quantidade de ferro em alimentos, especialmente aqueles de origem
vegetal.
Cálcio
O cálcio é necessário para a mineralização adequada e a manutenção
do osso em crescimento nas crianças. A RDA para o cálcio para
crianças de 1 a 3 anos de idade é de 700 mg/dia, para crianças de 4 a 8
anos é de 1.000 mg/dia e para aqueles de 9 a 18 anos é de 1.300 mg por
dia. A necessidade real depende das taxas de absorção individuais e
dos fatores dietéticos, tais como quantidades de proteínas, vitamina D
e fósforo. Como o leite e outros produtos lácteos são fontes primárias
de cálcio, as crianças que consomem quantidades limitadas desses
alimentos estão com frequência em risco de mineralização óssea
precária. Outros alimentos enriquecidos com cálcio, tais como leites de
soja e de arroz e sucos de frutas, também são boas fontes.
Zinco O zinco é essencial para o crescimento; uma deficiência resulta em
falha de crescimento, falta de apetite, diminuição da acuidade do
paladar e má cicatrização de feridas. Como as melhores fontes de
zinco são carne e frutos do mar, algumas crianças podem ter
regularmente baixas ingestões. O diagnóstico de
deficiência de zinco, especialmente a deficiência marginal, pode ser
difícil porque os parâmetros laboratoriais, incluindo plasma,
eritrócitos séricos, cabelo e urina são de valor limitado na
determinação da deficiência de zinco. Há uma influência positiva da
suplementação com zinco sobre o crescimento e as concentrações de
zinco no soro.
Vitamina D
A vitamina D é necessária para a absorção de cálcio e a deposição de
cálcio nos ossos; outras funções dentro do corpo, incluindo a
prevenção de doenças crônicas como câncer, doença cardiovascular e
diabetes, são áreas importantes de investigação em curso. Como este
nutriente também é formado a partir de exposição da pele à luz solar,
a quantidade necessária de fontes dietéticas depende de fatores como
a localização geográfica e o tempo que se passa ao ar livre.
A DRI para vitamina D para lactentes é de 400 UI (10 µg) por dia e
para crianças é de 600 UI (15 µg) por dia. O leite fortificado com
vitamina D é a fonte dietética principal deste nutriente, e os cereais
matinais e leites vegetais geralmente são fortificados com vitamina D. Os produtos lácteos, como queijo e iogurte, no entanto,
nem sempre são feitos a partir de leite fortificado. Os leites que não
são leite de vaca (p. ex., de cabra, de soja, de amêndoa ou de arroz)
podem não ser fortificados com vitamina D. Para as crianças
pequenas, a DRI atual para a vitamina D é mais elevada do que o que
pode ser consumido a partir de uma dieta típica. A suplementação
pode ser necessária após uma avaliação cuidadosa ou medição do
estado de vitamina D. Está ficando cada vez mais comum medir as
concentrações séricas de vitamina D 25 (OH) em crianças; todavia, há
alguma controvérsia sobre o que constitui as concentrações.
Suplementos de Vitaminas e Minerais
Quarenta por cento das crianças em idade pré-escolar recebem um
suplemento multivitamínico-mineral; esta percentagem diminui em
crianças mais velhas.
As evidências mostram que o flúor pode ajudar a prevenir a cárie
dentária. Se o abastecimento de água de uma comunidade não for
fluoretado, os suplementos de flúor são recomendados a partir dos 6
meses até os 16 anos de idade. Contudo, práticas familiares
individuais devem ser avaliadas, incluindo a origem da fonte primária
de fluidos da criança (p. ex., água potável, sucos ou outras bebidas) e
fontes de fluoreto provenientes de assistência à infância, escola, pasta
de dente e bochechos.
A Associação Americana de Pediatria não apoia a suplementação de rotina de quaisquer
vitaminas ou minerais para as crianças saudáveis, exceto para o flúor.
Entretanto, as crianças em risco de nutrição inadequada que podem se
beneficiar incluem aquelas (1) com anorexia, apetite inadequado ou
que consomem dietas da moda; (2) com doenças crônicas (p. ex.,
fibrose cística, doença inflamatória do intestino, doença hepática); (3)
de famílias com privação de alimentos ou que sofrem negligência ou
abuso parental; (4) que participam de um programa de dieta para o
tratamento de obesidade; (5) que consomem uma dieta vegetariana
sem produtos lácteos adequados; (6) com o crescimento oscilante
(dificuldade para se desenvolver); (7) com deficiências de
desenvolvimento.
As crianças que rotineiramente tomam um suplemento de múltiplas
vitaminas ou um suplemento vitamínico-mineral geralmente não
experimentam efeitos negativos se o suplemento contiver nutrientes
em quantidades que não excedam as DRI, especialmente o teor
máximo de ingestão tolerável. No entanto, alguns nutrientes podem
ser “esquecidos” por suplementos múltiplos vitamínicos gerais.
Embora muitas crianças consumam menos do que a quantidade
recomendada de cálcio, os suplementos de vitaminas e minerais para
crianças normalmente não contêm quantidades significativas de
cálcio. Por exemplo, em crianças entre 2 e 18 anos de idade que
tomaram suplementos, um terço não atinge as recomendações de
ingestão de cálcio e vitamina D, mesmo com suplementos. Além disso,
o uso de suplementos foi associado ao aumento da prevalência das
ingestões excessivas de ferro, zinco, vitamina A e ácido fólico (Bailey
et al., 2012). Além disso, uma análise dos suplementos comercializados
para lactentes e crianças indicaram que os suplementos disponíveis
não necessariamente preenchem as recomendações para a ingestão;
para alguns nutrientes, não é fornecido o suficiente, e para outros, os
suplementos fornecem quantidades excessivas (Madden et al., 2014).
As crianças não devem tomar megadoses, especialmente das
vitaminas lipossolúveis, porque grandes quantidades podem resultar
em toxicidade. A avaliação cuidadosa de cada suplemento pediátrico
é sugerida, porque muitos tipos estão disponíveis, mas incompletos.
Como muitos suplementos de vitaminas e minerais parecem e têm o
sabor de doces, os pais devem mantê-los fora do alcance das crianças
para evitar o consumo excessivo de nutrientes como o ferro.
Dietoterapia para Lactentes com
Baixo Peso ao Nascer:
A nutrição pode ser fornecida de muitas maneiras ao lactente com
BPN (prematuro baixo peso), cada uma com seus benefícios e limitações específicas. O
tamanho, a idade e a condição clínica da criança ditam os
requerimentos nutricionais e a maneira como podem ser atendidos.
Definições: um recém-nascido que, ao nascer, pesa menos de 2.500 g é
classificado como tendo baixo peso ao nascer (BPN); um lactente com
peso inferior a 1.500 g tem muito baixo peso ao nascer (MBPN); e um
recém-nascido com peso inferior a 1.000 g tem extremo baixo peso ao
nascer (EBPN).
O lactente a termo é aquele que nasce entre 37 e 42 semanas de
gestação. O lactente pré-termo (prematuro) nasce antes de 37 semanas
de gestação, enquanto o lactente pós-termo é aquele nascido após 42
semanas de gestação.
FIM: pag 3181
Características de Imaturidade
O recém-nascido prematuro ou com baixo peso ao nascer não teve a oportunidade de se desenvolver plenamente no útero e é fisiologicamente diferente do lactente a termo (Fig. 1).
Em decorrência disso, a criança com BPN apresenta vários problemas clínicos no início do período neonatal, dependendo do ambiente intrauterino, do grau de prematuridade, do trauma relacionado com o nascimento e do funcionamento dos sistemas de órgãos que são imaturos ou estão sob estresse. Certos problemas ocorrem com tanta frequência que são considerados típicos da prematuridade (Tabela 1).
Tabela 1. Problemas Comuns em Lactentes Pré-termo| Sistema | Problema |
| Respiratório | Síndrome do desconforto respiratório do recém-nascido, doença pulmonar crônica (displasia broncopulmonar) |
| Cardiovascular | Persistência do canal arterial |
| Renal | Desequilíbrio hídrico e eletrolítico |
| Neurológico | Hemorragia intraventricular, leucomalácia periventricular (necrose cerebral) |
| Metabólico | Hipoglicemia, hiperglicemia, hipocalcemia, acidose metabólica |
| Gastrointestinal | Hiperbilirrubinemia, intolerância alimentar, enterocolite necrosante |
| Hematológico | Anemia |
| Imunológico | Sepse, pneumonia, meningite |
| Outros | Apneia, bradicardia, cianose, osteopenia |
De Cloherty JP et al., editors: Manual of Neonatal care, 7. ed., Filadélfia, 2012, Wolters Kluwer/Lippincott Williams & Wilkins.
As crianças prematuras estão em alto risco de déficit no estado nutricional, em decorrência das baixas reservas de nutrientes, imaturidade fisiológica, doença (o que pode interferir no cuidado e nas necessidades nutricionais) e exigências nutricionais para o crescimento.
A maior parte das reservas fetais de nutrientes é depositada nos últimos 3 meses de gestação; portanto, o bebê prematuro começa a vida em um estado nutricional comprometido.
Como as reservas metabólicas (ou seja, energia) são limitadas, a terapia nutricional sob a forma de nutrição parenteral (NP), de nutrição enteral (NE), ou de ambas, deve ser iniciada o mais precocemente possível.
No recém nascido pré-termo com peso de 1.000 g, a gordura constitui apenas 1% da massa corporal total; por outro lado, o lactente a termo (3.500 g) tem um percentual de gordura de aproximadamente 16%. Por exemplo, um recém-nascido pré-termo AIG de 1.000 g tem uma reserva de glicogênio e gordura equivalente a cerca de 110 kcal/kg da massa corporal. Com necessidades metabólicas basais de cerca de 50 kcal/kg/dia, é óbvio que essa criança vai rapidamente ficar sem combustível proveniente de lipídeos e carboidratos, a menos que se estabeleça uma terapia nutricional adequada. O tempo de depleção é ainda mais curto para o lactente pré-termo com massa corporal inferior a 1.000 g ao nascimento. As reservas de nutrientes também se esgotam mais rapidamente em crianças pequenas que têm RCF como resultado da diminuição em suas reservas de nutrientes.Estimativas teóricas do tempo de sobrevivência de lactentes em estado de inanição e semi-inanição são apresentadas na Tabela 2. Essas estimativas assumem a depleção de toda a reserva de glicogênio e gordura e aproximadamente um terço da reserva de proteínas dos tecidos corporais a uma taxa de 50 kcal/kg/dia. Mostram-se os efeitos de líquidos fornecidos por via endovenosa como a água (que não tem energia exógenas) e solução de dextrose a 10% (D10W).
Tabela 2.
Atualmente, os líquidos via NP são iniciados no dia do nascimento, a fim de fornecer energia e proteínas à criança com MBPN. A ingestão precoce de proteínas promove um balanço nitrogenado positivo, concentração sérica normal de aminoácidos e tolerância à glicose.
O recém-nascido pré-termo pequeno é particularmente vulnerável à subnutrição. A desnutrição em lactentes prematuros pode aumentar o risco de infecção, prolongar a doença crônica e afetar negativamente o crescimento e o funcionamento do encéfalo. O recém-nascido prétermo alimentado com fórmula infantil para lactentes pré-termo ou com leite materno demonstra melhor crescimento e desenvolvimento do que crianças prematuras alimentadas com fórmulas infantis convencionais. A alimentação no primeiro mês de vida com o leite da mãe da própria criança tem sido associada a maior crescimento e desenvolvimento. O lactente pré-termo alimentado com o leite de sua própria mãe tem melhor desenvolvimento neurológico aos 30 meses de idade e escores mais altos em testes de inteligência aos 8 anos, além de encéfalos maiores e mais desenvolvidos aos 15 anos (American Academy of Pediatrics [AAP], Section on Breastfeeding, 2012; Issacs et al., 2010).
Necessidades nutricionais: alimentação parenteral
Muitos lactentes pré-termo em condição grave têm dificuldade de progredir para a alimentação enteral plena nos primeiros dias ou mesmo semanas de vida. A pequena capacidade do estômago da criança, o sistema gastrointestinal imaturo e a doença dificultam a progressão para a alimentação enteral plena. A NP torna-se essencial para a terapia nutricional, quer como suplemento à alimentação enteral, quer como fonte integral de nutrição.
Líquidos
Como as necessidades de líquidos variam amplamente para o lactente pré-termo, deve-se monitorar o balanço hídrico. A ingestão inadequada pode levar a desidratação, desequilíbrio eletrolítico e hipotensão; a ingestão excessiva pode levar a edema, insuficiência cardíaca congestiva e possível abertura do canal arterial. As complicações clínicas neonatais adicionais notificadas com a alta ingestão de líquidos incluem enterocolite necrosante (ECN) e displasia broncopulmonar (DBP).O lactente pré-termo apresenta percentagem de água no corpo (especialmente água extracelular) maior que a do recém-nascido a termo. A quantidade de água extracelular deve diminuir em todas as crianças nos primeiros dias de vida. Essa redução é acompanhada pela perda normal de 10% a 15% da massa corporal e melhora da função renal. A falha nessa transição na dinâmica dos líquidos e a ausência de diurese podem complicar o curso de evolução do lactente pré-termo com doenças respiratórias.
As necessidades de água são estimadas pela soma das perdas
prevista por pulmões e pele, urina e fezes, bem como pela água
necessária ao crescimento. A principal via de perda de água no recém nascido pré-termo é a evaporação através da pele e das vias
respiratórias. Essa perda de água insensível é mais elevada nos
lactentes menores e menos maduros, por causa de sua maior área de
superfície corporal em relação à massa corporal, do aumento da
permeabilidade da epiderme da pele à água e do maior fluxo
sanguíneo da pele em relação à taxa metabólica.
A perda de água
insensível é aumentada por berços aquecidos e luzes de fototerapia e
diminuída pelo uso de incubadoras com umidificadores, escudos
térmicos e cobertores térmicos. A perda insensível de água pode
variar de 50 a 100 mL/kg/dia no primeiro dia de vida e aumentar até
150 mL/kg/dia, dependendo do tamanho da criança, da idade
gestacional, dos dias de vida e do ambiente.
O uso de incubadoras
com umidificador pode diminuir a perda de água insensível e, assim,
também os requisitos de líquidos.
A excreção de urina, outra via principal de perda de água, varia de
1 a 3 mL/kg/h. Essa perda depende do volume de
líquidos e da carga de soluto apresentada aos rins. A capacidade da
criança de concentrar urina aumenta com a maturidade. Em geral, a
perda de água pelas fezes é de 5 a 10 mL/kg/dia; sugere-se que o ideal
para o crescimento seja de 10 a 15 mL/kg/dia (Dell, 2011).
Em razão das muitas variáveis que afetam a perda hídrica neonatal as necessidades de líquidos devem ser determinadas individualmente.
Normalmente, administram-se líquidos a uma taxa de 60 a 100
mL/kg/dia no primeiro dia de vida, a fim de atender às perdas
insensíveis e à produção de urina. As necessidades são, então,
determinadas por meio da avaliação da ingestão de líquidos. Os
resultados são comparados aos parâmetros clínicos de volume de
urina produzida e à concentração sérica de eletrólitos, creatinina e
nitrogênio da ureia sanguínea. A avaliação da massa corporal, da
pressão arterial, da perfusão periférica, do turgor da pele e da
umidade das mucosas é realizada diariamente. A administração diária
de líquidos geralmente é aumentada em 10 a 20 mL/kg/dia. No final
da segunda semana de vida, os lactentes prematuros podem receber
líquidos a uma taxa de 140 a 160 mL/kg/dia.
Pode ser necessária a
restrição de líquidos nos recém-nascidos pré-termo com PCA,
insuficiência cardíaca congestiva, insuficiência renal ou edema
cerebral. No entanto, o lactente pré-termo que é colocado sob luzes de
fototerapia ou em um berço aquecido precisa de mais líquidos, bem
como aquele que está em uma temperatura ambiente elevada ou cuja
temperatura central está alta.
Energia:
As necessidades energéticas do recém-nascido pré-termo alimentado
por via parenteral são menores que as do lactente alimentado por via
enteral, porque a perda na absorção não ocorre quando a ingestão
nutricional desvia o sistema intestinal. O recém-nascido pré-termo
alimentado por via enteral normalmente requer 105 a 130 kcal/kg/dia
para crescer, enquanto o lactente pré-termo alimentado por via
parenteral pode crescer bem se receber de 90 a 100 kcal/kg/dia (AAP,
2014). Devem-se fornecer as necessidades energéticas de manutenção
mínimas e uma quantidade adequada de proteínas o mais
rapidamente possível, a fim de evitar catabolismo tecidual. Fornecer
ao lactente com MBPN 1,5 g de proteínas e 40 a 60 kcal/kg/dia
promove o balanço nitrogenado durante os três primeiros dias de vida
(AAP, 2014; Rigo e Senterre, 2013).
Deve-se introduzir 2 a 3 g/kg/dia
de proteínas dentro de algumas horas após o nascimento, a fim de
maximizar o balanço nitrogenado e a concentração plasmática de
aminoácidos (AAP, 2014).
Deve-se aumentar a ingestão energética e proteica conforme a
condição da criança vai-se estabilizando e o crescimento torna-se o
objetivo (Tabela 42-3). Muitos lactentes com MBPN nascem Aadequado para a idade gestacional (AIG), mas,
ao receberem alta do hospital, pesam menos que o percentil 10 para
sua idade gestacional, de acordo com a data da última menstruação.
Esse novo estado de pequeno para a idade gestacional (PIG) é chamado de retardo do crescimento
extrauterino (RCEU). A RCEU pode ocorrer como resultado do déficit
na ingestão de energia e proteínas e crescimento diminuído associado
a doenças (Lapillonne e Grifin, 2013).

Glicose:
A glicose, ou dextrose, é a principal fonte de energia (3,4 kcal/g). No entanto, a tolerância à glicose é limitada em lactentes prematuros, especialmente nas crianças de muito baixa massa corporal, por causa
da produção inadequada de insulina, resistência à insulina e liberação continuada de glicose hepática enquanto a glicose intravenosa está sendo infundida. Há menor probabilidade de hiperglicemia quando a glicose é administrada com aminoácidos do que quando é infundida isoladamente. Os aminoácidos exercem efeito estimulador sobre a liberação de insulina.
É importante prevenir a hiperglicemia, porque ela pode levar à diurese e à desidratação.
A fim de prevenir a hiperglicemia em recém-nascidos de MBPN, a glicose deve ser administrada em pequenas quantidades. A carga glicêmica depende da concentração da infusão de dextrose e da velocidade com que é administrada (Tabela 42-4).
A administração de insulina exógena é evitada em recém-nascidos pré-termo (AAP, 2014). A insulina adere ao tubo endovenoso, o que resulta em flutuação da glicose no sangue, como resultado da concentração não constante de insulina.
Problemas adicionais para a criança incluem hipoglicemia, diminuição do crescimento linear, associação entre hipoglicemia e desenvolvimento neurológico, e morte (Alsweiler et al., 2012).
Em geral, os recém-nascidos pré––termo devem receber uma carga inicial de glicose de 4,5 a 6 mg/kg/min, com aumento gradual para 11 a 12 mg/kg/min. A carga de glicose pode ser avançada para 1 a 2 mg/kg/min/dia. A hipoglicemia não é um problema tão comum quanto a hiperglicemia, mas pode ocorrer se a infusão de glicose diminuir abruptamente ou for interrompida.
Aminoácidos:
As diretrizes para a ingestão de proteínas variam de 2,7 a 4 g/ kg/dia (AAP, 2014). Não se deve exceder essa quantidade de proteínas na solução parenteral porque mais proteínas não oferecem qualquer vantagem aparente, além de aumentar o risco de problemas metabólicos.
Na prática, os recém-nascidos pré-termo normalmente recebem 2 a 3 g/kg/dia de proteínas nos primeiros dias de vida e, então, as proteínas são fornecidas conforme tolerado. Muitos berçários mantêm estoques de soluções de NP inicial – que são compostas por água, glicose, proteínas e, às vezes, cálcio – que estão disponíveis 24 horas por dia. Os lactentes podem, então, receber proteínas assim que chegam ao berçário.
As soluções de aminoácidos convencionais não são projetadas para atender às necessidades específicas dos lactentes imaturos e podem provocar desequilíbrio na concentração sérica de aminoácidos. Por exemplo, os teores de cisteína, tirosina e taurina nessas soluções são baixos em relação às necessidades do lactente prematuro, mas os teores de metionina e glicina são relativamente elevados. Como o recém-nascido pré-termo não sintetiza eficazmente a cisteína a partir da metionina por causa de uma redução nas concentrações da enzima hepática cistationase, sugere-se o uso de um suplemento de cisteína. A cisteína é insolúvel e instável em solução; assim, é adicionada ao cloridrato de cisteína quando a solução de NP é preparada.
Além de desequilíbrio nos aminoácidos plasmáticos, outros problemas metabólicos associados à infusão de aminoácidos em lactentes prematuros incluem acidose metabólica, hiperamonemia e
azotemia. Esses problemas podem ser minimizados com a utilização de produtos de aminoácidos cristalinos e seguindo as diretrizes recomendadas para carga de proteínas (Tabela 42-5).
Lipídeos:
As emulsões lipídicas intravenosas são usadas por duas razões:
(1) atender às necessidades de ácidos graxos essenciais (AGE) e
(2) fornecer uma fonte concentrada de energia.
As necessidades de AGE podem ser atendidas fornecendo 0,5 g/kg/dia de lipídeos. Observaram-se evidências bioquímicas de deficiência de AGE durante a primeira semana de vida em recém-nascidos de muito baixa massa corporal alimentados por via parenteral sem lipídeos.
As consequências clínicas da deficiência de AGE podem incluir alterações na coagulação, surfactante pulmonar anormal e efeitos adversos sobre o metabolismo do pulmão.
Os lipídeos podem ser iniciados a 1 a 2 g/kg/dia e devem ser fornecidos ao longo de 24 horas (AAP, 2014). Os lipídeos podem ser avançados para 1 a 2 g/kg/dia, até que seja alcançada uma taxa de 3 g/kg/dia (Tabela 42-6).
Deve-se monitorar a concentração plasmática de triglicerídeos, porque concentrações elevadas de triglicerídeos podem desenvolver-se em crianças com diminuição na capacidade de hidrolisar triglicerídeos. Essas crianças geralmente têm menor idade gestacional, são PIG, têm infecção, estresse cirúrgico ou doença hepática. O monitoramento da concentração sérica de triglicerídeos é indicado, e pode ser necessária uma taxa inferior a 3 g/kg/dia de gordura para manter a concentração sérica de triglicerídeos abaixo de 200 mg/dL (AAP, 2014). Uma vez que a criança está clinicamente estável e precisa de energia adicional para o crescimento, as cargas de lipídeos podem ser aumentadas lentamente.
É possível fornecer intralipídeos à criança com hiperbilirrubinemia. Na recomendação atual de 3 g/kg/dia, administrada ao longo de 24 horas, não há deslocamento de bilirrubina dos sítios de ligação à albumina (AAP, 2014).
A carga total de lipídeos geralmente é de 25% a 40% das calorias de
origem não proteica (AAP, 2014). Para o recém-nascido pré-termo,
recomendam-se as soluções a 20%, que fornecem 2 kcal/mL, porque a
concentração sérica de triglicerídeos, colesterol e fosfolipídeos
geralmente é mais baixa que nas emulsões a 10%. As emulsões a 10%
contêm mais fosfolipídeos emulsificadores por grama de lipídeos, e
esse emulsificador diminui a quebra de triglicerídeos.
As emulsões lipídicas intravenosas são feitas de óleo de soja e
contêm ácidos graxos ômega-6, ácido linoleico e ácido araquidônico
(ARA). Esses AGE aumentam a produção dos mediadores
inflamatórios e o estado inflamatório do lactente (Premkumar et al.,
2014). Existe
uma emulsão lipídica intravenosa à base de óleo de peixe que contém
ácidos graxos ômega-3: ácido eicosapentaenoico (AEP) e
docosahexaenoico (ADH). Esses ácidos graxos ômega-3 são antiinflamatórios e revelam-se úteis no tratamento da doença hepática
associada à nutrição parenteral (Premkumar et al., 2014).
Outra emulsão lipídica europeia, a SMOF (óleo de soja, triglicerídeos
de cadeia média, azeite de oliva e óleo de peixe) acaba de ser
disponibilizada nos Estados Unidos. Essa mistura de óleos também pode oferecer
propriedades anti-inflamatórias (Vanek et al., 2012).
Com frequência, a carnitina é adicionada às soluções de NP para
prematuros. A carnitina facilita o mecanismo pelo qual os ácidos
graxos são transportados pela membrana mitocondrial, o que
possibilita sua oxidação para fornecer energia. Como os lipídeos
intravenosos não contêm carnitina e os recém-nascidos pré-termo têm
limitação na capacidade de produzir carnitina, a suplementação com
carnitina pode ser útil a lactentes pré-termo que estão recebendo
apenas NP por 2 a 3 semanas (Hay et al., 2014).
Eletrólitos:
Após os primeiros dias de vida, o sódio, o potássio e o cloreto são adicionados às soluções parenterais para compensar a perda de fluido extracelular.
Para evitar hipercalemia e arritmias cardíacas, o uso de potássio deve ser suspenso até que se veja fluxo renal. Em geral, o recém-nascido pré-termo tem os mesmos requerimentos de eletrólitos que o lactente a termo. Contudo, seus requerimentos reais variam, dependendo de fatores como função renal, estado de hidratação e utilização de diuréticos (Tabela 42-7). Lactentes muito imaturos podem apresentar limitação na capacidade de conservar sódio e, portanto, necessitar de maiores quantidades de sódio para manter a concentração sérica normal desse eletrólito. A concentração sérica de eletrólitos deve ser periodicamente monitorada.
Minerais:
O cálcio e o fósforo são componentes importantes da solução de NP.
Os recém-nascidos pré-termo que recebem NP com baixas concentrações de cálcio e fósforo estão em risco de desenvolver osteopenia da prematuridade. Esse déficit na mineralização óssea tem maior propensão a se desenvolver no lactente com MBPN que recebe NP por períodos prolongados.
O estado de cálcio e fósforo deve ser monitorado por meio da concentração sérica de cálcio, fósforo e fosfatase alcalina. Os níveis de atividade da fosfatase alcalina em recém-nascidos pré-termo são maiores que aqueles observados em adultos. É comum ver níveis de até 600 UI/L, o que pode refletir o rápido crescimento ósseo (Abrams, 2012). Quando os níveis de atividade da fosfatase alcalina de 800 UI/L ou mais persistirem, devem-se examinar as radiografias de joelho ou punho, à procura de raquitismo (Abrams, 2012). A elevação na atividade da fosfatase alcalina também pode ser encontrada na doença hepática.
O lactente pré-termo tem maior necessidade de cálcio e fósforo do que as crianças nascidas a termo. No entanto, é difícil adicionar uma quantidade suficiente de cálcio e fósforo às soluções parenterais para atender a essas exigências mais elevadas sem causar precipitação dos minerais. O cálcio e o fósforo devem ser fornecidos simultaneamente nas soluções de NP. Não se recomendam as infusões em dias alternados porque levam a uma concentração sérica anormal de minerais e à diminuição na retenção do mineral.
As recomendações atuais para a administração parenteral de cálcio, fósforo e magnésio adicional são apresentadas na Tabela 42.8. As ingestões são expressas num volume de 120 a 150 mL/kg/dia, com 2,5
g/100 mL de aminoácidos ou proteínas. Volumes mais baixos de líquido ou concentrações mais baixas de proteínas podem fazer que os minerais se precipitem da solução. A adição de cloridrato de cisteína aumenta a acidez do líquido, o que inibe a precipitação de cálcio e fósforo.
Essas recomendações assumem uma ingestão de líquidos média de 120 a 150 mL/kg/dia com 2,5 g de aminoácidos a cada 100 mL. A concentração de aminoácidos impede a precipitação desses minerais.
Oligoelementos:
Deve-se administrar zinco a todos os recém-nascidos pré-termo que recebem NP. Se a alimentação enteral não puder ser iniciada com 2 semanas de idade, devem-se adicionar oligoelementos. No entanto, a quantidade de manganês deve ser reduzida em crianças com icterícia obstrutiva; e a quantidade de selênio e cromo deve ser diminuída nos lactentes com disfunção renal. O cobre pode estar concentrado no fígado com colestase, e recomenda-se determinar o estado de cobre por dosagem da concentração plasmática desse mineral ou de ceruloplasmina (AAP, 2014).
A administração parenteral de ferro não é rotineiramente fornecida, já que os lactentes muitas vezes recebem transfusão de sangue logo após o nascimento, e a alimentação enteral, que é uma fonte de ferro, frequentemente pode ser iniciada. Se necessário, a dosagem para administração parenteral de ferro é de cerca de 10% da dosagem enteral; as diretrizes variam de 0,2 a 0,25 mg/kg/dia (resultados de Domellöf, 2014). A Tabela 42-9 fornece diretrizes para a administração de oligoelementos.

Vitaminas:
Logo após o nascimento, todos os lactentes recebem uma injeção intramuscular (IM) de 0,3 a 1 mg de vitamina K para prevenir a doença hemorrágica do recém-nascido pela deficiência de vitamina K.
Os estoques de vitamina K são baixos no lactente, e há pouca produção de vitamina K pela microbiota intestinal até que colonização bacteriana tenha ocorrido. Como a ingestão inicial de vitamina K é limitada, os recém-nascidos estão em risco nutricional se não receberem esse suplemento IM.
Devem-se administrar apenas preparações intravenosas de multivitamínicos atualmente aprovadas e concebidas para utilização em crianças, a fim de fornecer a ingestão adequada de vitamina e evitar a toxicidade dos aditivos utilizados em injeções de multivitamínicos destinadas a adultos. A American Academy of Pediatrics recomenda a infusão de 40% do frasco pediátrico de 5 mL de multivitamínico (MVI) por quilograma de massa corporal (AAP, 2014). A dose máxima de 5 mL é dada a uma criança com um massa corporal de 2,5 kg (Tabela 42-10).

A síndrome do desconforto respiratório do recém-nascido (SDRRN) é uma doença que acomete ocorre nos lactentes pré-termo logo após o nascimento porque essas crianças apresentam deficiência de uma substância do pulmão denominada surfactante. O surfactante é responsável por manter a elasticidade do pulmão durante a respiração; assim, administra-se suplementação com surfactante ao lactente para evitar a SDRRN ou para atenuar a doença. Os lipídeos e proteínas são componentes do agente tensioativo, e os fosfolipídeos são seu principal lipídeo. A colina é necessária à síntese de fosfolipídeos, mas a suplementação com colina não aumenta a produção de fosfolipídeos (van Aerde e Narvey, 2006). A colina é um nutriente condicionalmente essencial, pois a criança pode sintetizar colina. A colina é adicionada às fórmulas infantis destinadas ao recém-nascido pré-termo, com o mesmo teor do leite materno. Seu teor máximo é extrapolado do teor de segurança utilizado em adultos (Klein, 2002).
A displasia broncopulmonar (DBP) é uma doença pulmonar crônica que comumente se desenvolve na criança prematura como resultado da SDRRN e da ventilação mecânica e do oxigênio utilizados no tratamento dessa condição. Em decorrência do papel da vitamina A, no sentido de facilitar o reparo tecidual, e por causa dos relatos de recém-nascidos pré-termo com baixas reservas de vitamina A, sugere-se a utilização de grandes doses suplementares de vitamina A para a prevenção da DBP.
Um estudo sugere que fornecer injeções IM de vitamina A a 5.000 unidades/dia, 3 vezes por semana, durante o primeiro mês de vida, a lactentes pré-termo de EBPN diminui a incidência de DBP (Tyson et al., 1999). Os médicos podem ou não usar essa suplementação. A decisão baseia-se na incidência de DBP em seu berçário, ausência de benefícios adicionais comprovados, aceitabilidade do uso de injeções IM e disponibilidade de vitamina A parenteral (Darlow e Graham, 2011).
A apneia da prematuridade ocorre quando a criança para de respirar por 20 segundos ou mais. A apneia pode ser decorrente da imaturidade da resposta da criança à respiração. A bradicardia, a desaceleração do ritmo cardíaco e a má oxigenação do sangue podem estar associadas à apneia. A medicação, cafeína, pode ser administrada diariamente, a fim de apneia da prematuridade. A cafeína estimula a criança a respirar, aumentando a sensibilidade do cérebro ao dióxido de carbono, estimulando o impulso respiratório central e melhorando a contração do músculo diafragma. A apneia também pode ser causada pela falta de oxigênio, por temperaturas ambientais frias ou quentes, medicamentos ou doença. Deve-se determinar a causa da apneia, a fim de fornecer o tratamento correto
ao recém-nascido pré-termo.
Administra-se sacarose oral às crianças para o manejo da dor durante procedimentos como exames de sangue por punção do calcanhar ou punção venosa. O sabor da sacarose pode liberar endorfinas, mas o modo como a sacarose ajuda no tratamento da dor não é claro.
Transição da alimentação parenteral para a alimentação enteral:
É benéfico introduzir a alimentação enteral para o recém-nascido prétermo o mais precocemente possível, porque as mamadas estimulam o desenvolvimento e a atividade enzimática gastrointestinal, promovem o fluxo de bile, aceleram o crescimento das vilosidades do intestino delgado e promovem a motilidade gastrointestinal madura.
Essas dietas enterais iniciais também podem diminuir a incidência de icterícia colestática e a duração da icterícia fisiológica. Podem ainda melhorar a posterior tolerância à alimentação no lactente pré-termo.
Às vezes, utilizam-se dietas iniciais pequenas apenas para preparar o intestino, não se destinando a otimizar o consumo enteral de nutrientes até que a criança demonstre tolerância à alimentação ou esteja clinicamente estável.
Ao fazer a transição da alimentação parenteral para a alimentação enteral, os nutricionistas devem manter a alimentação parenteral até que a alimentação enteral esteja bem estabelecida, a fim de manter a ingestão adequada de líquidos e nutrientes. Em recém-nascidos de muito baixo peso, pode levar de 7 a 14 dias para que se forneça a alimentação enteral completa, e pode demorar ainda mais para lactentes com intolerância alimentar ou doenças. As crianças menores e mais enfermas geralmente recebem incrementos de apenas 10 a 20 mL/kg/dia. Recém-nascidos pré-termo maiores e mais estáveis são capazes de tolerar incrementos de 20 a 30 mL/kg/dia.
Necessidades nutricionais: alimentação enteral
A alimentação enteral é a preferida para o recém-nascido pré-termo porque é mais fisiológica que a alimentação parenteral e nutricionalmente melhor.
É benéfico iniciar uma pequena quantidade de alimentação adequada com leite materno sempre que possível (Ahrabi e Schanler, 2013). No entanto, determinar quando e como fornecer a alimentação enteral muitas vezes é difícil. Isso envolve levar em conta o grau de prematuridade, a história de insultos perinatais, a condição clínica atual, a função do sistema gastrointestinal, o estado respiratório e várias outras questões individuais (Tabela 42-11).
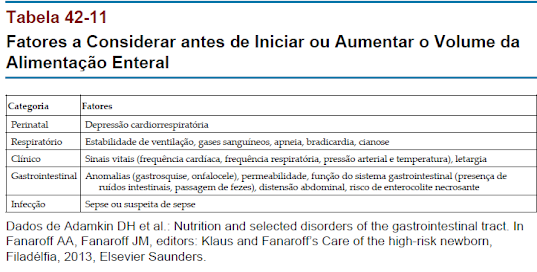
Os lactentes pré-termo devem ser alimentados o suficiente para promover crescimento semelhante ao de um feto com a mesma idade gestacional, mas não demais a ponto de se desenvolver toxicidade por nutrientes. Embora as necessidades nutricionais exatas do recém nascido pré-termo sejam desconhecidas, existem várias diretrizes úteis.
Em geral, as necessidades do lactente pré-termo são mais elevadas que as de crianças nascidas a termo, pois o pré-termo tem menores reservas de nutrientes, diminuição na capacidade de digestão e absorção, e uma taxa de crescimento rápida. O estresse, a doença e determinados tratamentos para doenças podem ainda influenciar as necessidades nutricionais.
Também é importante lembrar que, em geral, os requisitos nutricionais enterais são diferentes dos requerimentos parenterais.
Energia
As necessidades energéticas do recém-nascido pré-termo variam de acordo com fatores biológicos e ambientais. Estima-se que seja necessária uma dose de 50 kcal/kg/dia para assegurar as necessidades energéticas de manutenção, em comparação a 105 a 130 kcal/ kg/dia para o crescimento (Tabela 42-12).
No entanto, as necessidades energéticas podem ser aumentadas por estresse, doença e crescimento rápido. Do mesmo modo, as necessidades energéticas podem ser reduzidas se a criança for colocada em um ambiente térmico neutro (temperatura ambiente em que a criança gasta menor quantidade de energia para manter a temperatura corporal). É importante considerar a velocidade de crescimento em relação ao consumo energético médio.
Alguns recém-nascidos pré-termo podem precisar de mais de 130 kcal/kg/dia para sustentar uma taxa adequada de crescimento. O lactente prematuro com EBPN ou aqueles com DBP muitas vezes precisam dessas quantidades aumentadas. A fim de fornecer uma quantidade tão grande de energia para as crianças com capacidade limitada de tolerar grandes volumes de líquidos, pode ser necessário concentrar a alimentação a um teor > do que 0,8 kcal mL (24 kcal/oz-onça) (Quadro 42-12).
ProteínasDevem-se considerar a quantidade e a qualidade das proteínas ao determinar as necessidades proteicas do recém-nascido pré-termo. Devem-se fornecer aminoácidos a um teor que atenda à demanda sem induzir à toxicidade por aminoácidos ou proteínas.Utilizou-se um modelo fetal de referência para determinar a quantidade de proteína a ser ingerida, a fim de coincidir com a quantidade de proteína depositada no tecido fetal recém-formado (Ziegler, 2011). Para alcançar essas taxas de acreção fetais, deve-se fornecer proteína adicional, compensando, assim, as perdas intestinais e as perdas obrigatórias pela urina e pele. Com base nese método para determinar as necessidades de proteína, o consumo aconselhável é de 3,5 a 4 g/kg/dia. Essa quantidade de proteína é bem tolerada. Para a criança com EBPN, recomenda-se o consumo de até 4,5 g/kg/dia de proteínas nas mamadas (Agostoni et al., 2010; Koletzko et al., 2014; Tudehope et al., 2013).A qualidade ou o tipo de proteínas são considerações importantes, pois o recém-nascido pré-termo tem necessidade de aminoácidos distintas da dos nascidos a termo, por causa da imaturidade das vias enzimáticas do fígado. A composição dos aminoácidos das proteínas do soro do leite, que difere da composição da caseína, é mais adequada para lactentes pré-termo. O aminoácido essencial cisteína é mais altamente concentrado nas proteínas do soro do leite, e o lactente pré-termo não sintetiza bem a cisteína. Além disso, os aminoácidos fenilalanina e tirosina são mais baixos, e o lactente pré-termo tem dificuldade para oxidá-los. Ademais, a acidose metabólica diminui com o consumo de fórmulas em que predomina o soro do leite. Por causa das vantagens da proteína do soro do leite para o lactente pré- termo, deve-se optar, sempre que possível, pelo leite materno ou por fórmulas que contenham predominantemente proteínas do soro do leite.A taurina é um aminoácido sulfônico que pode ser importante para o lactente pré-termo. O leite materno é uma rica fonte de taurina, e essa substância é adicionada à maior parte das fórmulas infantis. Os recém-nascidos pré-termo e a termo desenvolvem baixa
concentraçãoões plasmáticas e urinárias de taurina sem uma fonte dietética. O recém-nascido pré-termo pode ter dificuldade em sintetizar a taurina a partir da cisteína. Embora nenhuma doença clara tenha sido relatada em lactentes alimentados com fórmulas pobres em taurina, o baixo teor de taurina pode afetar o desenvolvimento da visão e da audição (Klein, 2002).Deve-se fornecer energia em quantidade suficiente para possibilitar que as proteínas sejam utilizadas para o crescimento, e não apenas para o gasto energético. Recomenda-se o consumo de 2,5 a 3,6 gramas de proteínas por 100 kcal. A ingestão inadequada de proteínas limita o crescimento, enquanto a ingestão excessiva provoca concentração plasmática elevada de aminoácidos, azotemia e acidose.
Fonte:
1. Krause - Alimentos, Nutrição e Dietoterapia. 14ª Edição, Ed. Elsevier, 2018.



















