Com o aumento da idade, declínios físicos e cognitivos podem ocorrer. Até que ponto as mudanças associadas à idade na regulação hormonal e aumentos na prevalência de doenças específicas as doenças endócrinas contribuem para o declínio da função física e cognitiva não é completamente compreendida. Até que ponto as mudanças hormonais, com a idade, são consideradas “envelhecimento normal” versus “envelhecimento endócrino” pode ser arbitrário e depende em parte se o tratamento é atualmente indicado.
Quatro eixos hipotálamo-hipófisarios são apresentados: hormônio do crescimento, adrenal, gonadal (dividido em ovariano e testicular) e tireóide. Estes são seguidos por osteoporose, deficiência de vitamina D, diabetes e distúrbios hidroelétroliticos.
1. Eixo do Hormônio do Crescimento
O hormônio do crescimento (GH) é secretado de forma pulsátil. O pico da secreção de GH ocorre no meio da puberdade (2), diminuindo subseqüentemente em 50% a cada 7 a 10 anos.
Uma redução do fator de crescimento semelhante à insulina 1 (IGF-1) ocorre em paralelo com o declínio na média da secreção de GH no envelhecimento.
No momento em que a oitava década é atingida, os níveis de GH são semelhantes aos de adultos jovens com deficiência de GH. A frequência do pulso é semelhante ao longo da idade, com aproximadamente 18 episódios secretores de GH por 24 horas em crianças, adultos jovens e indivíduos mais velhos (4). O declínio do GH com o envelhecimento é observado principalmente na amplitude dos episódios secretores, embora os níveis de interpulso também diminuam (Fig. 1). Uma redução dos níveis séricos do fator de crescimento semelhante à insulina 1 (IGF-1) ocorre em paralelo com o declínio da secreção média de GH no envelhecimento.

Fig. 1 - Perfis médios de 24 horas de acil-grelina (curva azul) e GH (curva amarela) em 6 idosos saudáveis (A) e 8 homens jovens saudáveis (B); adultos jovens são incluídos para comparação. Observe diferentes escalas para velhos (painel superior) e jovens (painel inferior) entre os grupos. As setas indicam refeições padronizadas às 8h, 13h e 18h. Os indivíduos foram autorizados a dormir depois das 21:00. Redesenhado de Nass R et al.
Em mulheres na pré-menopausa, os níveis máximos de GH são maiores do que em homens. Isso provavelmente se deve à sensibilidade reduzida do receptor de GH no fígado e, portanto, níveis mais altos de GH são necessários para manter os níveis séricos normais de IGF-1. Após a menopausa, GH os níveis são semelhantes entre mulheres e homens de idade semelhante. A suplementação oral de estrogênio inibe a síntese hepática de IGF-1 e aumenta a secreção de GH por meio da inibição do feedback negativo, enquanto os níveis de IGF-1 aumentam e a secreção de GH permanece inalterado quando o estrogênio é administrado pela via transdérmica.
O declínio na síntese e secreção de GH, com o envelhecimento, é bem documentado em todas as espécies de mamíferos. Em humanos, assim como em outras espécies, a diminuição da produção de GH/IGF-1 está correlacionada com o aumento da porcentagem de gordura visceral e corporal, diminuição da massa muscular, diminuição da aptidão física, diminuição da função imunológica e declínios fisiológicos nas concentrações de estrogênio e androgênio. Se esta diminuição na secreção de GH é causadora ou apenas correlativa é controverso.
Em crianças e adultos com deficiência de GH, sua reposição tem demonstrado benefícios na composição corporal, lipídios séricos, condicionamento físico e densidade óssea; também aumenta a velocidade do crescimento em crianças. No entanto, potenciais efeitos adversos do GH na estimulação da malignidade, são preocupações da terapia com GH em indivíduos mais velhos.
A deficiência de GH prolonga a expectativa de vida ?
A restrição calórica e alterações genéticas que reduzem a função nas vias GH/IGF-1/insulina foram demonstrados em modelos experimentais de animais invertebrados e vertebrados levando ao prolongamento da vida útil. Modelos de camundongos de mutantes que não liberam GH e que são insensíveis ao GH significativamente mais longos têm expectativa de vida mais curta.
Se isso se traduz em humanos não está claro. No entanto, estes são experimentos ao longo da vida e provavelmente não são aplicáveis ao envelhecimento em humanos. Isso foi revisado recentemente no contexto de humanos com um tipo de deficiência isolada de GH (IGHD) 1B, devido a uma mutação do gene do receptor GHRH, no Município de Itabaianinha, Brasil. Indivíduos com DIGH têm baixa estatura, fácies de boneca, vozes agudas e obesidade central. Eles têm puberdade atrasada, mas são férteis e geralmente saudáveis.
Além disso, esses indivíduos com IGHD estão parcialmente protegidos contra o câncer e alguns dos efeitos comuns do envelhecimento e podem atingir longevidade extrema. Em contraste, o nanismo associado à deficiência de GH encurta o tempo de vida médio. Existem estudos que sugerem que indivíduos com níveis séricos mais baixos de IGF-I têm maior tempo de vida, potencialmente devido a deleções do exon 3 do receptor de GH, e que indivíduos com outras variantes de GHR têm grandes reduções na incidência de câncer e diabetes mas sem efeitos sobre o tempo de vida.
Em um estudo com homens mais velhos ativos (n = 84) e mulheres (n = 41) ciclistas de 55 a 79 anos, foi demonstrado que o IGF-1 diminuiu com a idade, enquanto a testosterona nos homens não. Os autores sugerem que as alterações hormonais do envelhecimento envolvem não apenas o processo de envelhecimento, mas também a inatividade.
Terapias Disponíveis
Não há terapias aprovadas para reverter o declínio da secreção de GH associado à idade.
O uso GH recombinante (rhGH) é aprovado em pacientes pediátricos com distúrbios de falha de crescimento ou baixa estatura e em adultos com deficiência do GH ou com caquexia por HIV/AIDS.
Existem secretagogos de GHRH e GH, mas não são aprovados para uso como agentes antienvelhecimento.
Dados de ensaios clínicos sobre eficácia e segurança em idosos
Em 2007, Liu et al publicaram uma revisão sistemática de ensaios clínicos do uso de rhGH versus placebo, com ou sem intervenções no estilo de vida. Um total de 220 idosos saudáveis foram inscritos e acompanhados por ano. O tratamento médio foi de 27 semanas com uma dose média de 14 ug/kg dia. Ocorreram pequenas mudanças na composição corporal (redução da massa gorda [-2,1 kg (95% CI, -2,8 a -1,35 kg)] e aumento na massa magra massa corporal [2,1 kg (IC, 1,3 a 2,9 kg)], maior em homens do que em mulheres) à custa de uma taxa aumentada de eventos adversos.
Estes incluíram edema dos tecidos moles, artralgias, síndrome do túnel do carpo e ginecomastia, bem como maior aparecimento de diabetes mellitus e glicemia alterada de jejum.
A conclusão desta revisão foi que o rhGH não pode ser recomendado como terapia antienvelhecimento.
Dois estudos randomizados, controlados por placebo, dos secretagogos GH sec MK-677 e capromorelina em indivíduos idosos demonstraram que esses agentes orais aumentam os níveis de GH aumentando a amplitude dos pulsos de GH para níveis relatados em indivíduos jovens. Esses compostos também têm a vantagem de não poderem ser dosados, devido à retroalimentação do IGF-1. A principal diferença entre os dois estudos estava no seleção dos participantes. No estudo MK-0677, foram estudados indivíduos saudáveis, enquanto no estudo da capromorelina, os participantes apresentavam comprometimento funcional leve.
Pontos chave
• No momento, nenhuma terapia para aumentar a secreção ou ação do GH está aprovada como uma intervenção antienvelhecimento.
• Estudos com rhGH e secretagogos de GH falharam em demonstrar benefícios que superem os riscos. No entanto, é possível que o benefício possa ser maximizado com o uso de doses mais baixas, em populações de estudo com pior desempenho físico e em combinação com exercício e nutrição, sem os efeitos adversos observados nos estudos.
Lacunas na pesquisa médica
Estudos em modelos de invertebrados e vertebrados são importantes, mas podem não ser traduzíveis para humanos. A maioria dos estudos em animais investigou intervenções ao longo da vida da função somatotrófica super ou hipoativa. Intervir em diferentes estágios do ciclo de vida pode ajudar a explicar os dados conflitantes sobre se a função somatotrófica insuficiente ou excessiva pode ser benéfica para prolongar a expectativa de vida.
As mudanças na secreção de GH ao longo do ciclo de vida tornam problemática a interpretação de estudos em animais e sua tradução para humanos.
O objetivo deve ser melhorar o tempo com saúde em vez do tempo de vida. Assim, estudos adicionais de aumento ou diminuição da função somatotrópica em diferentes estágios do ciclo de vida serão importantes, particularmente para avaliar se a restauração da secreção pulsátil de GH como observada em indivíduos de 20 a 30 anos de idade ajudaria a prevenir o desenvolvimento de fragilidade e sarcopenia sem riscos crescentes.
É claro que o tratamento hormonal sozinho não será suficiente, então ensaios futuros exigirão a avaliação de doses mais baixas de secretagogos de GH/GH considerando a combinação com exercícios, intervenções nutricionais e/ou co-suplementação de outros hormônios (por exemplo, testosterona). Visar as populações certas, como aquelas que desenvolveram ou estão em alto risco de fragilidade e sarcopenia, também será vital. Novos estudos precisarão ser realizados por vários anos ou mais.
2. Eixo adrenal
Dados de História Natural/Observacionais em Idosos
As glândulas adrenais produzem várias classes de hormônios de diferentes tipos. O córtex adrenal sintetiza hormônios esteróides e precursores hormonais, principalmente o mineralocorticóide aldosterona da zona glomerulosa, o glicocorticóide cortisol da zona fasciculada e os precursores androgênicos dehidroepiandrosterona (DHEA) e seu sulfato (DHEAS) da zona reticular (Fig. 2). O DHEAS é em grande parte uma forma de armazenamento e produto excretado, com conversão em DHEA em alguns tecidos. A medula adrenal é uma extensão do sistema nervoso simpático, que secreta epinefrina.
Fig. 2 - O hipotálamo integra sinais do ambiente e dos centros cerebrais superiores para liberar o hormônio liberador da corticotropina (CRH), que estimula a produção pituitária de adrenocorticotropina (ACTH). O ACTH impulsiona a produção de cortisol, bem como neuroesteróides e seus precursores, 11β-hidroxiandrostenediona (11OHA4) e dehidroepiandrosterona e seu sulfato (DHEA [S]). O cortisol fornece feedback negativo (linhas vermelhas) ao hipotálamo e à hipófise, não apenas ao cortisol, mas também a todos os outros esteroides estimulados pelo ACTH. O DHEA e o DHEAS podem ser metabolizados nos andrógenos testosterona e di-hidrotestosterona (T, DHT), enquanto o 11OHA4 é metabolizado nos andrógenos 11-cetotestosterona (11KT) e 11-cetodi-hidrotestosterona (11KDHT). O cortisol e os neuroesteróides exercem ações importantes no cérebro que controlam o humor, a memória e a cognição. Independentemente, a aldosterona é produzida sob o sistema renina-angiotensina 2 (AT2), ou autonomamente, como a partir de micronódulos produtores de aldosterona (APMs). A aldosterona regula o equilíbrio de sódio e o excesso de aldosterona causa hipertensão e doença cardiovascular. No envelhecimento, o feedback negativo do cortisol é atenuado e, enquanto a produção de DHEAS cai, a síntese de cortisol e 11OHA4 é preservada. Os APMs aumentam com a idade, e os potenciais efeitos deletérios do excesso de cortisol e aldosterona são ampliados com o envelhecimento.
Os lactentes produzem grandes quantidades de aldosterona para compensar a resistência do rim neonatal aos mineralocorticóides e o baixo teor de sódio do leite humano. Com o tempo, o teor de sódio da dieta aumenta e a necessidade de aldosterona diminui; a maioria dos adultos americanos consome mais de 150 meq de sódio diariamente. Ao invés de ter uma zona glomerulosa uniforme e contínua, como visto em crianças e adultos jovens, as glândulas adrenais de adultos nos países ocidentais tornam-se cada vez mais descontínuas após os 40 anos de idade.
Estudos de imuno-histoquímica revelam bolsões de células que expressam a enzima aldosterona sintase (CYP11B2) abaixo da cápsula adrenal, inicialmente denominadas aglomerados de células produtoras de aldosterona e agora chamadas de micronódulos produtores de aldosterona (APMs). As células APM comumente abrigam mutações somáticas em genes que codificam subunidades de canais iônicos que regulam a produção de aldosterona. Como o número de glândulas adrenais com uma zona glomerulosa contínua diminui com a idade, o número desses APMs e sua área total aumentam paralelamente .
Pontos chave
• APMs que produzem aldosterona autonomamente começam a desenvolvem-se na idade adulta e acumulam-se com a idade.
• O eixo HPA mostra menos sensibilidade ao feedback negativo, mudanças diurnas atenuadas e alterações na interconversão cortisol/cortisona com o envelhecimento.
• Embora as concentrações circulantes de DHEA e DHEAS diminui com a idade, cortisol e 11-ketoandrógenos não diminua ou suba ligeiramente.
• A modulação da sinalização do cortisol pode ser benéfica em uma série de doenças que se tornam mais comuns em homens mais velhos e mulheres.
• A suplementação sistêmica de DHEA não mostrou grandes benefícios em indivíduos mais velhos.
3. Eixo ovariano
Sintomas vasomotores e risco cardiovascular
Em aproximadamente um quarto das mulheres, os sintomas vasomotores (SVM) começam mais de uma década antes da menopausa e duram mais de uma dúzia de anos depois.
O estudo de longo prazo SWAN mostrou uma associação entre a frequência de SVM e aumento dos fatores de risco de DCV, DCV subclínica e eventos cardiovasculares.
Aspectos clínicos do envelhecimento ovariano
Independentemente da etiologia da insuficiência ovariana, duas clínicas principais surgem sequelas médicas:
- declínio progressivo da fertilidade, refletindo a redução do número e da qualidade dos folículos ovarianos e
- cessação dos ciclos menstruais mensais, refletindo o paralelo declínio dos hormônios esteróides ovarianos.
Consequentemente, podemos ter sintomas (SVM, síndrome geniturinária da menopausa (SGM), humor desordenado, distúrbios do sono, distúrbios sexuais) e efeitos sistêmicos (amenorreia, perda óssea,
síndrome metabólica, aumento do risco cardiovascular, declínio cognitivo).
Aumento dos SVM com o aumento da idade
Estudos observacionais e ensaios clínicos com participantes de idade avançada sugerem que aproximadamente 7% das mulheres mais velhas continuem a experimentar os SVM.
Se os SVM persistem a partir da menopausa, reaparecem após um período de inatividade ou surgem de novo décadas depois, não foi verificado. A complexa interação entre os SVM e um aumento de 5 a 9 vezes nos eventos cardiovasculares após terapia de reposição hormonal (TRH) em mulheres idosas participantes do Estudo Heart (estudo de Reposição de Estrogênio/progesterona (HERS) e a Iniciativa de Saúde da Mulher (WHI) ressalta a necessidade de mais pesquisas sobre a etiologia, características,
e consequências dos SVM com o envelhecimento.
Tratamentos disponíveis
O espectro de terapias baseadas em evidências para alívio dos SVM varia de TRH a medicamentos não hormonais prescritos a comportamentais mente-cérebro, incluindo a terapia Cognitivo comportamental e hipnose. Decisões relativas a escolha ideal para a mulher incorpora seu grau de incômodo com os sintomas, preferências pessoais, DCV e avaliações de risco de câncer de mama e estado uterino.
O tratamento da síndrome genitourinária da menopausa inclui hidratantes e lubrificadores de venda livre, estrogênios vaginais, DHEA e ospemifeno.
Como nenhuma preparação de testosterona é adequada e liberada pelo FDA ema mulheres, a titulação de terapias aprovadas para homens tem sido recomendado para o tratamento do distúrbio sexual hipoativo em mulheres.
Dados de ensaios clínicos sobre eficácia e segurança em idosos
Para esta discussão, “mais velho” abrange mulheres após a menopausa (geralmente > 50 anos), tendo em mente que a Terapia de Reposição Hormonal é indicada para mulheres mais jovens que experimentem hipogonadismo ou insuficiência ovariana primária e é recomendado até a idade prevista da menopausa.
Embora as preparações, as vias de administração e as dosagens da TRH expandiram acentuadamente desde o primeiro uso de estrogênios conjugados de equinos na década de 1940, a principal indicação para TH em mulheres com menopausa natural continua sendo o tratamento de sintomas (SVM e SGM).
A prevenção da osteoporose é outra indicação aprovada de TRH, para mulheres na pós-menopausa com risco significativo de osteoporose e para quem outras terapias aprovadas não são toleradas nem apropriadas. Indicações preventivas adicionais foram consideradas e estão atualmente em revisão.
Os resultados dos ensaios de prevenção da doença cardíaca coronária secundária (DCC) foram decepcionantes. Em contraste com o benefício previsto da doença coronariana com base em uma miríade de estudos observacionais, os ensaios revelaram um aumento no infarto do miocárdio no primeiro ano de terapia e falha na redução da doença coronariana, eventos ou progressão da aterosclerose coronariana.
Os ensaios clínicos da Iniciativa de Saúde da Mulher (Women’s Health Initiative) foram iniciados em 1992 para determinar se uma TRH [estrogênios equinos conjugados (EEC) ± acetato de medroxiprogesterona, dependendo do estado uterino], quando iniciado em mulheres saudáveis com idades entre 50 e 79 anos, reduziria a incidência de doenças crônicas do envelhecimento (doenças do miocárdio, infarto e morte por doença coronariana, osteoporose, câncer de cólon) e resultados de segurança (acidente vascular cerebral, tromboembolismo venoso câncer de mama e endométrio.
O braço do estudo com terapia conjugada foi interrompido após 5,6 anos, e o braço apenas de estrogênio após 7,2 anos, porque os riscos gerais (aumento de acidente vascular cerebral em ambos os ensaios e ataque cardíaco, embolia pulmonar e mama câncer no braço combinado) excedeu os benefícios preventivos (fraturas reduzidas, câncer de cólon, diabetes).
Análises subseqüentes mostraram um perfil benefício/risco mais favorável em mulheres mais jovens (50 a 59 anos) ou naquelas mais próximas (<10 anos) da menopausa, enquanto o risco de acidente vascular cerebral aumentou quando a TRH foi iniciada > 60 anos, o risco de demência aumentou > 65 anos e os eventos coronarianos aumentaram > aos 70 anos.
O acumulado de 13 anos de acompanhamento forneceu evidências de suporte adicionais. No 18º ano, a mortalidade geral não aumentou para nenhum grupo. Além disso, a mortalidade por todas as causas diminuiu 21% naquelas com idades entre 50 e 59 anos no momento do inicio no braço exclusivo com estrogênios equinos conjugados, com benefício máximo de mortalidade – uma redução de 40% – para aqueles com ooforectomia bilateral < 45 anos.
Observou-se, apos acompanhamento de 13 anos, persistência do aumento significativo de 28% no risco de câncer de mama com a TRH combinada. Em contraste, houve uma diminuição de 21% apenas com os EEC. Aos 20 anos de acompanhamento cumulativo, estes resultados persistiram, com a ressalva adicional que a mortalidade por câncer de mama foi significativamente reduzido apenas no braço com EEC. Estas descobertas refletem as complexidades destas preparações hormonais na incidência do câncer da mama e sua mortalidade e não deve ser extrapolado para outros tipos de TRH.
Embora faltem ensaios clínicos randomizados adequados, estudos observacionais não sugerem que a administração de estradiol iniba o câncer de mama, enquanto a progesterona pode ter menos efeitos estimulantes do câncer de mama do que o acetato de medroxiprogesterona (MPG).
A escassez das evidências de segurança dos ensaios clínicos randomizados significa que a TRH geralmente não é prescrita para mulheres com histórico de câncer de mama; o alívio dos sintomas com opções não hormonais é recomendado.
Em resumo, a Iniciativa para a Saúde da Mulher estabeleceu a segurança da TRH para mulheres mais jovens na pós-menopausa (< 60 anos ou <10 anos desde a menopausa), destacou a divergência de resultados de DCV e câncer de mama apenas para a EEC versus terapia combinada com MPG e estudos observacionais confirmados sugerindo benefício de mortalidade para mulheres com menopausa precoce
que usaram apenas EEC após ooforectomia.
A hipótese temporal
A hipótese do momento sugere que a TRH reduz a aterosclerose quando iniciada próximo à menopausa, mas não se iniciada em um período tardio, posterior à menopausa, possivelmente devido a mudanças na sinalização do receptor de estrogênio.
A hipótese temporal também poderia explicar as descobertas de um estudo que avaliou os efeitos do estradiol transdérmico na sensibilidade a insulina. Vários ECRs projetados especificamente para examinar os efeitos na coronariopatia da hipótese temporal produziu resultados inconsistentes. As Diretrizes atuais não recomendam prescrever TRH apenas para prevenção de doença coronariana em mulheres pós-menopáusadas.
Dose/tipo de TRH e duração
Na ausência de ensaios clínicos adequados, estudos observacionais e meta-análises fornecem algumas evidências de que resultados de segurança - particularmente para tromboembolismo venoso e riscos de acidente vascular cerebral - são melhorados com menores doses e preparações transdérmicas de estradiol.
Seguindo os relatórios iniciais do Women’s Health Initiative, foi recomendado limitar a TRM em 3 a 5 anos para minimizar o risco de câncer de mama.
Tanto a North American Menopause Society (NAMS) e o American College of Obstetricians and Gynecologists (ACOG) posteriormente emitiram declarações que permitem maior duração da TRH em mulheres saudáveis ≥ 65 anos, sem contraindicações, após avaliação anual dos riscos e benefícios previstos e reavaliação do estado de saúde individual.
A recomendação para tomada de decisão compartilhada reflete a existência de evidências de longo prazo sobre riscos e benefícios para mulheres que iniciam TRH visando o alívio dos sintomas na menopausa por um período prolongado. Medidas uteis incluem a redução progressiva da dose e mudança para preparações orais transdérmicas.
• A menopausa e o estado pós-menopausa são naturais, manifestações pré-programadas do envelhecimento ovariano caracterizadas por perda de fertilidade e profunda redução da fertilidade produção ovariana de hormônios.
• Os sintomas da menopausa são comuns, variam em grau de incomodo e podem ser efetivamente tratados com uma variedade de agentes comprovadamente eficazes em RCTs.
• O início da TRH é mais seguro quando reservado para mulheres em proximidade (<10 anos) da transição para a menopausa ou menos de 60 anos, sem contra-indicações e com riscos aceitáveis de DCV e câncer de mama.
• A continuação da TRH pode ser considerada individualmente dependendo dos desejos pessoais, estado de saúde e tomada de decisão compartilhada.
• Embora a TRH tenha sido estudado mais extensivamente, dependendo do estado de saúde e idade, com base em estudos observacionais prospectivos, doses mais baixas e terapias transdérmicas podem ser mais seguras com menos eventos tromboembólicos, menos efeitos metabólicos indesejáveis e possivelmente menos eventos cardiovasculares.
• O delineamento do papel fisiológico da kisspeptina, neuroquinina Y e neurônios dinorfina no controle da secreção de sintomas vasomotores e gonadotrofinas e esteróides sexuais permite possíveis novas opções de tratamento, conforme demonstrado em RCTs concluídos e em andamento do antagonista do receptor da neuroquinina 3 (NK3R).
4. Eixo testicular
Pontos chave
Estudos de imunoensaio relataram um declínio gradual, modesto, mas inconsistente nos níveis de testosterona com a idade entre os homens ocidentais. Esses estudos destacam que fatores de estilo de vida contribuem para a redução da testosterona no sangue relacionada à idade, notadamente sobrepeso/obesidade, resistência à insulina ou diabetes, tabagismo, doenças cardiovasculares e depressão.
Isso explicaria a maioria ou todas as aparentes reduções relacionadas à idade da testosterona sérica.
Há pesquisas inadequadas sobre se a testosterona melhora essas comorbidades do envelhecimento. Além disso, existem especulações interessantes baseadas em intervenções limitadas, observacionais e mecanicistas sugerindo efeitos androgênicos na telomerase como uma potencial influência hormonal em um mecanismo subjacente do envelhecimento.
Pontos chave
• A espermatogênese e a esteroidogênese são ambas negativamente impactadas por comorbidades associadas ao envelhecimento, em vez do que o próprio envelhecimento.
• A Disfunção Eretil raramente é causada por deficiência androgênica. Os inibidores da Fosfodiesterase do tipo 5 são um tratamento eficaz para homens mais velhos com ED: avanafil, sildenafil, etc
• O uso de imunoensaios de esteróides para medição de testosterona em vez dos ensaios de LC-MS (preferidos-cromatografia liquida esteroide por espectometria de massa) pode resultar no diagnóstico inadequado de baixos níveis de testosterona.
• Os Ensaios de Testosterona mostraram benefícios modestos, transitórios, no tratamento com testosterona para a função sexual, pequenos aumentos esperados na hemoglobina e densidade óssea, mas sem benefícios para a vitalidade, função física ou cognitiva e efeito adverso da testosterona em aumentar o tamanho da placa coronária não calcificada. Esses dados não suportam o uso de testosterona para tratar essas comorbidades de homens mais velhos.
• Um grande estudo de segurança (TRAVERSE) está em andamento para avaliar os eventos cardiovasculares durante 5 anos com tratamento diário de testosterona vs placebo.
Lacunas na pesquisa médica
- Dada a falta de eficácia convincente e segurança incerta da administração de testosterona a homens idosos sem patologia reprodutiva, a pesquisa clínica futura sobre o tratamento com testosterona deve se concentrar principalmente em saber se a testosterona melhora as comorbidades do envelhecimento e/ou tem efeitos diretos sobre os supostos mecanismos subjacentes do envelhecimento, e qual seria o limiar da testosterona administrada.
- Os potenciais efeitos adversos da administração de testosterona a longo prazo em doenças cardiovasculares e da próstata em tais homens também requerem pesquisas adicionais. Além disso, na ausência de quaisquer distúrbios naturais de secreção excessiva de testosterona em homens, possivelmente refletindo a tolerância evolutiva para aumentos acentuados na secreção de testosterona durante a puberdade masculina, exploração cuidadosa da eficácia e segurança de doses mais altas de curto prazo testosterona ou outros andrógenos naturais não aromatizáveis (por exemplo, DHT, andrógenos não esteróides) para comorbidades específicas do envelhecimento podem ser justificadas.
- Embora a terapêutica clínica sempre exija estudos duplo cegos, placebo controlados de andrógenos naturais ou sintéticos, a pesquisa analítica em mecanismos celulares e moleculares de ação de andrógenos em tecidos-alvo chave (músculo, fígado, linhagens de células eritróides, osso, próstata, pele, cérebro) são necessários para identificar moduladores parácrinos ou intermediários direcionados da ação androgênica, o que poderia apontar o caminho para os benefícios da ação androgênica alvo-específica, evitando efeitos prejudiciais fora do alvo.
- Outras pesquisas analíticas também são necessários para entender as origens testiculares dos efeitos da idade paterna nos resultados reprodutivos e na preservação da função testicular.
5. Eixo tiroideano
Pontos chave
• Uma concentração de TSH acima do intervalo de referência com uma concentração normal de T4 livre é comum em indivíduos mais velhos. Concentrações isoladas de T3 abaixo das faixas de referência também são comuns nessa faixa etária.
Distribuição das concentrações de TSH em uma população de referência da Pesquisa Nacional de Saúde e Nutrição (USA)
- Indivíduos mais velhos com hipotireoidismo subclínico persistente com concentrações de TSH <7 mIU/L não devem ser tratados com levotiroxina.
- Se subgrupos de indivíduos mais velhos com hipotireoidismo subclínico persistente que têm concentração de TSH ≥7 mIU/L ou sintomas significativos devem ser tratados com levotiroxina é um tema de debate.
- Os limiares de TSH para tratamento de hipertireoidismo subclínico foram estabelecidos a partir de dados observacionais, mas esses limiares de tratamento e gerenciamento ideal não foram testados em RCTs.
6. Osteoporose
A osteoporose é um distúrbio esquelético crônico resultante da perda óssea progressiva após a menopausa em mulheres e com o avanço da idade em homens e mulheres.
Esta perda óssea gradualmente interrompe a microarquitetura óssea, prejudicando a resistência e predispondo à fratura. Pacientes com alto risco de a fratura podem ser prontamente identificados e estratégias eficazes para reduzir o risco de fratura estão disponíveis.

Prevalência de fraturas de quadril, coluna e todas as fraturas em mulheres por década de idade no estudo DUBBO. A combinação das fraturas de quadril e coluna representaram 24% de todas as fraturas entre as idades de 60 e 69 anos, 44% entre 70 e 79 anos, e 67% na faixa etária de + de 80 anos.
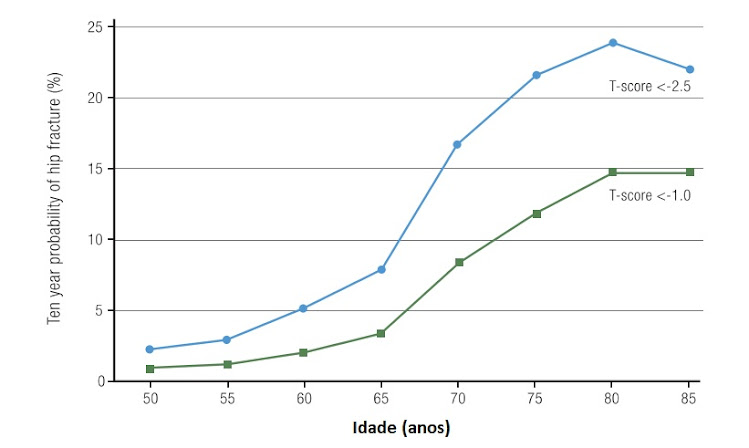
A maioria das fraturas ocorre após uma queda. A Osteoporose e a Sarcopenia, um fator de risco para quedas, frequentemente ocorrem juntas em idosos adultos. Pelo menos um terço das mulheres com 65 anos ou mais sofre uma queda a cada ano, com o risco de quedas aumentando com o avançar da idade. Interações importantes existem entre os fatores de risco mais fortes para fratura: idade avançada, DMO baixa e história de fratura ou queda. As mulheres mais velhas correm maior risco do que mulheres mais jovens com o mesmo T-score e podem estar em alto risco de fratura sem baixa DMO (Fig. 8). Uma história de fratura anterior resulta em uma duplicação do risco de fratura futura e esse risco é especialmente alto nos primeiros 2 anos após um incidente. Além disso, a fratura subsequente em pacientes mais velhos adultos é mais provável que seja uma fratura grave.
Relação entre idade e risco de fratura de quadril em mulheres com valores de T-score do colo do fêmur < -1 e < -2,5
Guidelines recomendam o teste de DMO para todas as mulheres com 65 anos ou mais. O teste de DMO em homens tem sido sugerido aos 70 anos. A avaliação para causas secundárias da osteoporose é justificada, incluindo síndrome de Cushing exógena e exógena, hipogonadismo masculino, hipertireoidismo clínico e deficiência grave de vitamina D.
Tratamentos disponíveis
O tratamento para reduzir o risco de fratura começa minimizando os fatores de risco e com medidas gerais, incluindo boa nutrição, evitar o fumo e praticar atividade física regular.
Abordagens multidisciplinares para a prevenção do risco de queda - incluindo exercícios para promover força e equilíbrio, corrigir déficits visuais, evitar ou minimizar medicamentos como diuréticos tiazídicos, sedativos e bloqueadores alfa associados ao risco de queda, eliminando os riscos em casa e o uso adequado de dispositivos auxiliares - podem reduzir o risco de queda, mas nenhum deles foram avaliados em estudos grandes o suficientes para demonstrar a redução nas fraturas.
Estas medidas gerais e estratégias de prevenção de quedas são recomendados para todos os adultos mais velhos para promover a saúde óssea bem como a saúde geral, com terapia farmacológica reservada para pacientes com alto risco de fratura.
Múltiplos fármacos com mecanismos de ação variados foram para o tratamento de osteoporose
(Tabela 3).
Cada medicamento reduz o risco de fratura vertebral em mulheres na pós-menopausa com osteoporose, e todos, exceto raloxifeno e ibandronato, reduzem o risco de fratura não vertebral.
A redução do risco de fratura de quadril foi demonstrada com o alendronato, risedronato, zoledronato, denosumabe e romosozumabe.
Os agentes anti-remodeladores reduzem a remodelação óssea e aumentam a DMO e a força, mas não reparam o dano microarquitetural da osteoporose. Agentes osteoanabólicos ou de construção óssea aumentam a formação óssea e melhoram a arquitetura trabecular.
Agentes osteoanabólicos são mais eficazes do que os bisfosfonatos orais na melhora da DMO e na redução do risco de fratura em adultos mais velhos.
Drogas formadoras de osso são recomendadas para pacientes em risco de fratura muito alto (escore T ≤ −3,0 na ausência de fratura por fragilidade, escore T ≤ −2,5 mais uma fratura por fragilidade, fraturas vertebrais graves ou múltiplas).
Dados recentes demonstram uma forte relação entre alterações associadas ao tratamento na DMO e redução do risco de fratura. Isso levou a um conceito emergente de terapia direcionada a objetivos usando a DMO total do quadril como um “alvo” informando a escolha da terapia inicial e as decisões sobre as subsequentes terapias.
- O raloxifeno (Evista 60 mg-Lilly), um agonista/antagonista do estrogênio, é um agente antiremodelador fraco que reduz o risco de fratura vertebral, mas não de outras fraturas.
A calcitonina de salmão é um fraco inibidor da reabsorção óssea que pode reduzir o risco de fratura vertebral. Por causa de um possível risco de câncer associado à terapia com calcitonina de salmão, este medicamento não é mais aprovado na Europa. Ela pode ser considerada como uma terapia de curto prazo para alívio da dor após uma lesão vertebral aguda com fratura.
- Os bisfosfonatos são os fármacos mais utilizados para tratamento da osteoporose. Com exceção do ibandronato, os bisfosfonatos aprovados reduzem os riscos de fraturas vertebrais, não vertebrais e fratura de quadril. Enquanto a osteonecrose da mandíbula e do eixo femoral com características atípicas foram descritas como terapia de longo prazo com bisfosfonatos, o perfil benefício/risco permanece favorável por até 10 anos em pacientes com alto risco de fratura.
- No entanto, o uso de bisfosfonatos além de 5 anos não resulta no aumento adicional da DMO ou redução do risco de fratura.
- As diretrizes recomendam a reavaliação do risco de fratura após 3 a 5 anos de terapia com bisfosfonatos. Para pacientes que não têm mais com alto risco de fratura e que não atendem mais aos critérios para o tratamento, a interrupção da terapia pode ser considerada até o paciente novamente atender aos critérios de tratamento.
- Para pacientes que permanecem com alto risco de fratura após 5 anos de tratamento com bisfosfonatos, mudar para denosumabe (Prolia - solução injetável
60 mg/mL) ou um dos agentes de construção óssea.
O Denosumabe (Prolia) é um anticorpo monoclonal humano administrado por via subcutânea a cada 6 meses, o que reduz os riscos de lesões vertebrais, não vertebrais e fratura de quadril. Foram observados aumentos progressivos da DMO, manutenção ou redução do risco de fratura, e segurança clínica ao longo de 10 anos de terapia.
Embora não haja limite para a duração da terapia com denosumabe, a descontinuação da terapia resulta em um rebote nos marcadores de remodelação óssea, perda rápida da DMO, da proteção contra fraturas vertebrais e aumento do risco de fraturas múltiplas.
O Alendronato ou zoledronato devem ser administrados sempre que denosumabe for descontinuado para mitigar esses efeitos indesejáveis.
- A Teriparatida (Forteo sol 250 mcg/mL refil de 2,4 mL-Lilly) e a Abaloparatida (Evenity sol injetável 90 mg/mL-Angen) são agonistas dos receptores do hormônio paratireóideo que ativam a formação óssea e, em menor grau, a reabsorção óssea. Ambas as drogas demonstraram reduzir fraturas vertebrais e não vertebrais, mas nenhuma reduziu o risco de fratura de quadril nos ensaios clínicos principais. Essas drogas são administrados por injeção subcutânea diária, geralmente por 18 a 24 meses porque seus efeitos anabólicos diminuem com o uso prolongado. Recomenda-se potentes agentes anti-remodelação após um ciclo desses agentes para manter os benefícios esqueléticos.
- O Romosozumab é um anticorpo anti-esclerostina que ativa a formação óssea enquanto inibe a reabsorção óssea. Administrado por injeção subcutânea uma vez por mês durante 12 meses, seguido por um bisfosfonato ou denosumabe. Esses regimes induzem maiores aumentos na DMO e maior redução no risco de fratura em 12 meses quando comparados ao placebo e ao alendronato. O aumento do risco cardiovascular foi observada em comparação com alendronato, mas não com placebo.

Pontos chave
• As fraturas relacionadas à osteoporose são comuns e frequentemente sérios problemas em indivíduos mais velhos.
• Pacientes idosos com alto risco de fratura podem ser prontamente identificados, especialmente aqueles com fratura recente.
• Assegurar uma boa nutrição e encorajar exercícios físicos regulares promove a saúde óssea.
• Medicamentos para reduzir o risco de fratura são eficazes e bem tolerados em pacientes idosos e devem ser considerados em todos os idosos com osteoporose, especialmente aqueles com histórico de fratura.
Lacunas na pesquisa
- Muitas vezes, as fraturas não são reconhecidas como relacionadas à osteoporose. Como resultado, a maioria dos pacientes idosos com fraturas nao são tratados para osteoporose. Estudos que avaliam estratégias para educar pacientes e médicos sobre a importância da osteoporose e os benefícios da terapia seriam úteis.
- São necessários estudos que comparem a eficácia e a segurança de medicamentos para osteoporose, especialmente em pacientes mais velhos. Nenhum dos estudos avaliando abordagens para reduzir o risco de quedas foram projetados para avaliar os efeitos sobre o risco de fratura.
- A Avaliação do papel das terapias senolíticas para prevenir efeitos do envelhecimento através da indução seletiva da morte de células senescentes deve incluir resultados esqueléticos.
7. Vitamina D
História natural/dados observacionais em idosos
A forma ativada da vitamina D é um hormônio esteróide que controla várias centenas de genes. Ela modula uma ampla gama de funções moleculares e celulares, incluindo imunidade, inflamação, senescência celular e biologia dos telômeros. A vitamina D pode desempenhar um papel duplo no envelhecimento, como fator de risco ou marcador de problemas de saúde e como possível medicamento terapêutico.
Alteração do Metabolismo da vitamina D com o envelhecimento
O envelhecimento afeta o metabolismo da vitamina D em vários aspectos importantes. A grande capacidade da pele de produzir vitamina D3 diminui com o envelhecimento, em cerca de 13% a cada década. Os indivíduos mais velhos são, no entanto, ainda são capazes de aumentar sua vitamina D3 sérica em resposta à exposição ao raio ultravioleta.
A diminuição da absorção de cálcio relacionada à idade é multifatorial. Inclui reduções no níveis séricos de 25 (OH) D, 1α-hidroxilação prejudicada em calcitriol, declínio da função renal, resistência intestinal ao efeito da vitamina D e reduções na pós-menopausa nos níveis de estrogênio.
A resistência renal ao hormônio da paratireóide, estimulação da 1α-hidroxilase (CYP27B1) e supressão do fator de crescimento fibroblástico 23 desta hidroxilase, são outros fatores possíveis. Estudos em animais também mostraram degradação aumentada e diminuição da produção de calcitriol e decréscimos relacionados à idade no receptor nuclear da vit. D e no transportador do cálcio renal.
Devido a essas alterações no metabolismo da vitamina D relacionadas à idade e às mudanças no estilo de vida, a deficiência de vitamina D é altamente prevalente em populações de alto risco, notadamente em indivíduos mais velhos. Uma infinidade de revisões sistemáticas e meta-análises examinaram o impacto da vitamina D na saúde e na doença ao longo dos últimos anos.
Associações de vitamina D e principais impactos na saúde de idosos
bvbvb
8. O Eixo Hipotálamo-Neurohipofisário-Renal
História natural/dados observacionais em idosos
O envelhecimento causa mudanças distintas que afetam a homeostase hídrica responsável pela manutenção do equilíbrio hídrico normal. O resultado dessas mudanças é que indivíduos mais velhos experimentam uma perda da reserva homeostática, com subsequente aumento da suscetibilidade a causas patológicas e iatrogênicas de distúrbios na homeostase da água.
Um claro déficit relacionado com a idade na resposta à sede parece surgir da diminuição da sensibilidade à estimulação osmótica. A sensação de sede e a resposta apropriada ao beber de vista do aumento da osmolalidade plasmática é comprometida em indivíduos mais velhos (Fig. 11). É provável que isso decocorra, pelo menos em parte, através da diminuição da atividade das vias neurais que transmitem informações sensoriais osmóticas para os centros corticais superiores onde a sede é percebida, e dos quais emanam as respostas de beber ativadas pela sede.

Figura 11. Concentração plasmática de sódio (Na+]) e ingestão total de água em indivíduos saudáveis, mais velhos e mais jovens, após 24 horas de desidratação. Na linha de base são mostradas as concentrações de sódio antes da desidratação (Pré) e após a desidratação (Pós). O livre acesso à água foi permitido durante 60 minutos após desidratação começando no tempo = 0 minutos. A ingestão cumulativa de água durante o período de consumo livre por indivíduos jovens e idosos é mostrada no gráfico de barras. Apesar de um aumento inicial maior na [Na+], os mais velhos beberam significativamente menos água, resultando em menor correção do nível sérico elevado [Na+].
Estudos sugeriram que esse defeito pode ser devido a uma maior ponto de ajuste osmótico, levando a uma resposta de sede embotada em idosos. Outros estudos demonstraram que há também uma mudança no controle da sede mediado por barorreceptores em indivíduos mais velhos; a expansão do volume plasmático em indivíduos mais velhos não gera a supressão normal da sede encontrada nos jovens.
É importante ressaltar que a perda da sede adequada a estímulos osmóticos e de volume comprometem
os mecanismos compensatórios críticos responsáveis pelo impulso para repor o fluido corporal perdido, o principal meio fisiológico de corrigir um estado hiperosmolar.
Tratamentos Disponíveis
Hiperosmolalidade e hipernatremia
A hidratação adequada é a base para prevenir a hiperosmolalidade e a hipernatremia em pacientes idosos. A hidratação agressiva com fluidos hipotônicos (D5W ou D5/0,5 NSS) é indicado para diminuir a [Na+] para níveis normais nas primeiras 48 horas de internação hospitalar. Um recente estudo retrospectivo de 449 pacientes hospitalizados com soro [Na+] >155 mmol/L mostraram que não havia evidências de que a correção rápida da hipertremia (>0,5 mmol/L/h) estivesse associada a uma maior risco de mortalidade, convulsão, alteração de consciência e/ ou edema cerebral em pacientes adultos gravemente enfermos com hipernatremia adquirida no hospital.
Pacientes idosos com diagnóstico estabelecido de deficiência da arginina vasopressina (AVP-diabetes insípido craniano) devem ser tratados com desmopressina como outros pacientes adultos. A desmopressina (DDAVP) é hormônio antidiurético. Porque a desmopressina é amplamente metabolizada através da excreção renal, indivíduos mais velhos são mais propensos à hiponatremia com a terapia com desmopressina devido à diminuição da Taxa de Filtração Glomerular à idade.
Hiposmolalidade e hiponatremia
O tratamento da hipo-osmolalidade e da hiponatremia em indivíduos mais velhos deve seguir as mesmas diretrizes que em indivíduos mais jovens, particularmente no que diz respeito aos limites de correção diária de soro [Na+] para evitar a síndrome de desmielinização osmótica.
A restrição hídrica é geralmente a primeira terapia empregada, mas tem eficácia limitada com aumentos médios na [Na+] numa faixa de 3 a 5 mmol/L.
Se o tratamento farmacológico é necessário, as escolhas incluem uréia, furosemida em combinação com comprimidos de NaCl, demeclociclina e antagonistas do receptor de vasopressina.
Embora alguns desses tratamentos possam ser eficazes em circunstâncias individuais, as únicas terapias atualmente aprovadas pelas agências reguladoras para o tratamento da hiponatremia são os antagonistas do receptor de vasopressina: (tolvaptan-Jinarc 60 mg).
Dados de ensaios clínicos sobre eficácia e segurança em idosos
Hiperosmolalidade e hipernatremia
Não existem ensaios clínicos recentes sobre a eficácia e segurança de tratamentos para doenças agudas e
crônicas com hipernatremia em indivíduos mais velhos. No entanto, vários ensaios foram publicados
sobre o uso de desmopressina para tratamento de noctúria. Estes descobriram uniformemente que os indivíduos mais velhos correm maior risco de desenvolver hiponatremia, mesmo com uma única dose baixa noturna de desmopressina, o que era particularmente verdadeiro em mulheres mais velhas devido a uma resposta melhorada a desmopressina provavelmente devido a uma diferença de sexo na expressão do receptor V2 da vassopressina nos rins.
Hiposmolalidade e hiponatremia
Vários ensaios clínicos randomizados e controlados foram publicados sobre a eficácia e segurança do antagonista da vasopressina no tratamentos da hiponatremia. No entanto, nenhum destes se concentraram especificamente em indivíduos mais velhos, muito embora muitos indivíduos mais velhos tenham sido incluídos no ensaio.
Pontos chave
• Déficits na função renal, sede e respostas da AVP à estimulação osmótica e de volume têm sido repetidamente demonstrados na população idosa, aumentando o risco de distúrbios da homeostase da água devido a fatores intrínsecos, doenças e causas iatrogênicas.
• Esses distúrbios têm implicações clínicas em termos de efeitos neurocognitivos, quedas, readmissão hospitalar e necessidade de cuidados de longo prazo, incidência de osteoporose, fraturas ósseas, e mortalidade de pacientes internados e ambulatoriais.
• Tratamentos eficazes para hiponatremia estão disponíveis, mas as indicações recomendadas para o tratamento da hiponatremia crônica com base em melhorias demonstradas na clínica carecem de resultados.
Lacunas na pesquisa
Ensaios clínicos avaliando a eficácia e segurança dos tratamentos de hipernatremia e hiponatremia em indivíduos mais velhos são necessários.
Estudos são necessários para determinar a etiologia da hiponatremia “idiopática”, particularmente em indivíduos mais velhos. Estudos adicionais sobre os efeitos da hiponatremia crônica sobre cérebro, ossos e outros órgãos, e a avaliação da reversibilidade desses efeitos com correção da hiponatremia, devem ser realizados.
De especial interesse serão os estudos para avaliar se um tratamento mais eficaz da hiponatremia pode reduzir a incidência de quedas e fraturas em pacientes idosos, o uso de recursos de saúde para pacientes internados e ambulatoriais com hiponatremia e o aumento da morbidade e mortalidade de pacientes com hiponatremia associada a múltiplos estados de doença.
Conseqüentemente, as indicações para tratamento de retenção de água, distúrbios em pacientes sem hiponatremia sintomática devem aguardar mais estudos especificamente concebidos para avaliar os efeitos do tratamento de pacientes hiponatrêmicos com resultados clinicamente relevantes, bem como na experiência clínica que melhor delineie a eficácia.
Fonte: Journal of Clinical Endocrinology & Metabolism 2023; 108: 1835–1874. https://doi.org/10.1210/clinem/dgad225