1. INTRODUÇÃO
Diferença entre SARCOPENIA, CAQUEXIA e DESNUTRIÇÃO
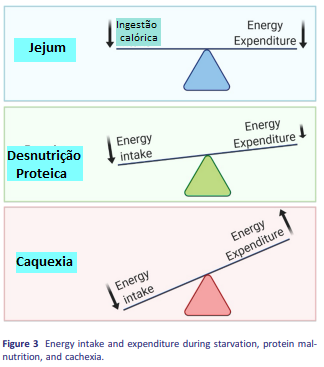
Características clínicas Sarcopenia Caquexia Desnutrição
Perda da força e massa Perda de peso Perda de peso
muscular e de massa muscular
Comprometimento funcional Indique a gravidade +++
Mecanismo Relacionado à idade, Patológico Ingestão calórica patológico inadequada, má
absorção
Doença(s) +/- +++ +/-
Inflamação +/- +++ -
Anorexia +/- ++ +/-
Massa gorda +/- Diminuída Diminuída
Degradação proteica +/- +++ +
Gasto energético de repouso Diminuído Aumentado Diminuído
Figura 1. Mecanismos fisiopatológicos para o desenvolvimento da sarcopenia em pacientes com doença cardiovascular.
2. Biomarcadores de Laboratório
Infelizmente, até o momento, não há um único biomarcador circulante que seja diagnóstico de sarcopenia, embora haja alguma promessa para o futuro.
Para a avaliação da massa muscular, o método de diluição da D3-creatinina (D3-Cr) é uma estratégia promissora com alta precisão. O ensaio mede a quantidade de creatinina deuterada de uma única análise de urina realizada 48 a 96 horas após a administração oral de um marcador D3-Cr. O D3-Cr atinge um nível estacionário no músculo esquelético ≈ 48 horas após a ingestão. Há uma rotatividade muscular esquelética de creatina razoavelmente constante a cada dia, de modo que a quantidade de D3-Cr na urina é proporcional à massa muscular corporal total. A D3-Cr se correlaciona bem com a massa muscular corporal total determinada por RM (r = 0,87) e é potencialmente mais preciso do que o DXA.
Uma alternativa mais simples ao D3-Cr para avaliação de marcadores circulantes de massa muscular foi proposta, chamada de índice de sarcopenia, que é representado pela equação (creatinina sérica/cistatina C sérica) × 100. Inicialmente proposto por Kim et al, o índice foi encontrado em adultos ambulatoriais associa-se fortemente com o DXA e também se correlacionam com a massa muscular em pacientes gravemente enfermos estimada por TC abdominal. O índice de sarcopenia mostrou ser prognóstico de morte intermediária em idosos hospitalizados anteriormente e evento cardiovascular adverso importante em adultos idosos com doença coronariana. O índice de sarcopenia alavanca o conceito de que a creatina é quase exclusivamente produzida pelo músculo, mas a cistatina C é produzida por todas as células nucleadas. Uma ressalva é que, embora a produção de cistatina C seja considerada estável, fatores como hipertireoidismo, malignidade e algumas formas de inflamação podem alterar os níveis de cistatina C.
3. TRATAMENTO
A sarcopenia é uma condição modificável que pode voltar ao estado normal com intervenção precoce (Figura 2). Tais intervenções podem ser igualmente importantes para aqueles com presarcopenia, que também é modificável. Por exemplo, em um estudo, os participantes com provável sarcopenia tiveram a mesma probabilidade de voltar ao normal ou progredir para sarcopenia no seguimento de 5 anos (10,7% versus 10,3%). Há também várias estratégias de manejo atualmente em investigação, incluindo exercício resistido, suplementos nutricionais e terapias hormonais ou farmacoterapêuticas (Tabela S6).
3.1. Tratamento das comorbidades
O primeiro passo para tratar a sarcopenia é identificar os fatores contribuintes subjacentes. Por exemplo, tratar e otimizar a saúde metabólica e abordar a obesidade por meio de exercícios e ingestão calórica pode reduzir a miosteatose. O tratamento de DCV concomitante que contribui para a inflamação é igualmente importante.
3.2. Treinamento com exercícios resistidos
Um fator importante no desenvolvimento da sarcopenia é a falta de atividade física seguida de resistência anabólica. Portanto, a evidência mais forte atualmente disponível para o tratamento e prevenção da sarcopenia é derivada de estudos sobre programas de intervenção de exercícios, como treinamento resistido e aeróbio, que demonstraram aumentar a massa muscular, a força e o desempenho físico.
Programas de treinamento resistido progressivo podem ser utilizados como uma intervenção bem-sucedida para o manejo da sarcopenia. Nesses programas, os participantes exercitam seus músculos contra o aumento da força externa por pelo menos 2 a 3 vezes por semana por uma duração de 8 a 12 semanas. A quantidade de resistência e a duração da sessão aumentam gradualmente ao longo do tempo, dependendo da capacidade e do progresso de cada indivíduo.
Em idosos saudáveis, a melhora na força muscular pode ser alcançada com apenas uma sessão de exercício resistido por semana. Li-ang et al observaram que, entre idosos sarcopênicos de 80 a 99 anos de idade, a combinação de resistência e esforço de equilíbrio duas vezes por semana durante 12 semanas conseguiu uma melhora significativa no desempenho das atividades de vida diária, com redução de 10% no risco absoluto do número de quedas em comparação com o exercício resistido isolado.
A hipertrofia muscular ocorre quando a síntese proteica no músculo excede a quebra proteica. Pacientes mais velhos que realizam exercício resistido apresentam um aumento característico na síntese proteica muscular sem aumento na quebra da proteína corporal total.
Roth et al demonstraram que o treinamento resistido aumenta significativamente a proporção de células satélites ativas tanto para idosos, de 65 a 75 anos, quanto para jovens, de 20 a 30 anos. No entanto, as mulheres mais velhas tiveram a melhora mais aumentada. Embora o aumento do tamanho das miofibras explique alguns ganhos de força clínica observados com programas de treinamento resistido, a maioria dos ganhos é derivada do aumento do recrutamento de unidades motoras e outras adaptações neurais.
O exercício aeróbico, como natação, caminhada e corrida, tem sido associado à melhora da aptidão cardiológica e do desempenho físico. Com o exercício aeróbico, os grandes grupos musculares se movem de maneira rítmica por um período sustentado de tempo que aumenta o gasto de energia. Demonstrou-se que aumenta a área de secção transversa das fibras musculares, mas é menos provável que cause hipertrofia muscular.
Após o exercício aeróbico isolado, o volume mitocondrial e a atividade enzimática aumentam, indicando que a qualidade da muscula melhora independentemente da idade. Em pacientes com IC e sarcopenia, a atividade aeróbica está associada à redução de hospitalizações e mortalidade, o que se acredita ser resultado de reduções nos marcadores inflamatórios do músculo esquelético, isoforma de óxido nítrico sintase e miostatina, e um aumento na área de secção transversa do músculo esquelético.
3.2 Intervenção Nutricional
A dieta com proteínas e aminoácidos pode ser uma intervenção importante para mitigar os efeitos negativos da sarcopenia. O papel das intervenções dietéticas, como proteínas, antioxidantes, creatina, ácidos graxos e vitamina D, foi avaliado. Em resumo, a suplementação de proteínas e aminoácidos parece ser a suplementação dietética mais promissora (Figura 2). A incorporação de concentrados de proteína (por exemplo, do soro de leite) ou aminoácidos de cadeia ramificada, como a leucina, na dieta pode aumentar a taxa de síntese de proteína muscular esquelética mista.
Recomenda-se 0,8 g/kg/d de proteína para todos os adultos para prevenir a perda de massa muscular. Apesar dessa recomendação, >38% dos homens mais velhos e 41% das mulheres mais velhas não atingem essa dose diária recomendada.
A Sociedade Europeia de Nutrição Clínica e Metabolismo recomenda que, para idosos saudáveis, a dieta deve fornecer pelo menos 1,0 a 1,2 g proteína/kg de peso corporal por dia. Para idosos desnutridos ou em risco de desnutrição devido a doenças agudas ou crônicas, a dieta deve fornecer pelo menos 1,2 a 1,5 g de proteína/kg de peso corporal por dia, e ingestão ainda maior de aqueles com doenças crônicas graves ou lesões. A sociedade também recomenda combinar uma dieta rica em proteínas com atividade física diária (resistência e exercícios aeróbicos) para todos os indivíduos mais velhos.
3.3 Treinamento Combinado de Exercícios Resistidos e Suplementação Proteica
Uma dieta inadequada em proteínas ou aminoácidos pode facilitar a perda de proteína muscular em adultos mais velhos, embotando a síntese proteica e promovendo o catabolismo proteico subsequente. Consumir uma dieta mais rica em proteínas do que a dose diária recomendada, mas dentro da Faixa de Distribuição Aceitável de Macronutrientes, pode ter benefícios para a saúde. Aliar uma dieta rica em proteínas com exercícios resistidos pode resultar em aumento da força muscular e maior preservação da massa muscular, principalmente quando consumida em estado de balanço energético negativo. Além disso, o efeito benéfico sobre a resposta sintética da proteína muscular é maior se a ingestão de proteína for distribuída entre as refeições de forma equilibrada. O tipo de proteína pode influenciar a digestão e absorção. Por exemplo, o soro de leite, uma proteína do leite, é descrito como uma proteína "rápida" porque libera aminoácidos rapidamente quando digerido, ao contrário da caseína, outra proteína do leite, que é considerada uma proteína "lenta". Em um estudo de Tang et al, o consumo de whey em homens jovens com exercício resistido resultou em maior síntese proteica muscular em comparação com a caseína. Iglay e cols conduziram um estudo no qual 36 homens e mulheres >50 anos de idade participaram de 12 semanas de treinamento de resistência em conjunto com uma ingestão proteica menor (0,9 g PTN/kg/dia) ou maior (1,2 g). Embora todas as medidas de desfecho tenham mostrado melhora global (por exemplo, aumento da massa de proteína corporal total, aumento da força e diminuição da massa gorda), não foram observadas diferenças entre os grupos com baixa e alta proteína.
Além disso, Andrews e cols propuseram que o consumo diário de proteína (1,35 versus 0,72 g de PTN/kg/dia) não tem efeito adicional sobre os ganhos de massa magra associados ao treinamento de resistência. A variabilidade no consumo de proteínas não se associou com a variabilidade na hipertrofia muscular entre os dois grupos. Mais estudos para investigar qual tipo de suplemento proteico é mais eficaz em uma melhora clinicamente significativa na função muscular são necessários.
3.4 Reposição de Testosterona
O nível de testosterona diminui gradualmente com o envelhecimento. Aos 60 anos de idade, quase 20% dos homens têm níveis de testosterona na faixa hipogonadal, e aos 80 anos de idade, >50% dos homens têm testosterona baixa. Embora a testosterona mais alta esteja ligada ao aumento da massa muscular e à diminuição da porcentagem de gordura corporal total em homens mais velhos, os estudos sobre o tratamento com testosterona em homens mais velhos são controversos, e os resultados variaram de acordo com a dosagem, o assunto e o método de administração de testosterona (Tabela S6).
Vários estudos descobriram que a suplementação oral de testosterona foi associada com o aumento da massa magra, extensão do joelho, melhora da força de pressão torácica e potência de subir escadas, e diminuição da massa gorda. Outros estudos relataram nenhuma diferença na força muscular, desempenho, e atividade com a suplementação de testosterona. Dados os resultados mistos, a terapia com testosterona não pode ser recomendada como uma terapia de rotina para a sarcopenia, especialmente devido aos riscos potencialmente aumentados da terapia com testosterona em certas subpopulações com DCV.
3.5 Moduladores seletivos do receptor de andrógeno
O GTx-024 (enobosarm/Ostarine) é um agente que tem mostrado um aumento dose-dependente na massa corporal magra total e melhora no desempenho físico, como o teste de subida de escada. Embora o enobosarm e outros moduladores seletivos do receptor de andrógeno tenham demonstrado melhora na massa muscular magra, a melhora na função física não tem sido consistente. Além disso, dano hepático agudo foi relatado com o uso de moduladores seletivos do receptor de andrógeno como um evento adverso importante. Essas drogas ainda não estão disponíveis, e mais estudos são necessários para estabelecer sua eficácia e segurança em pacientes com sarcopenia.
3.6 Inibidores da enzima conversora da angiotensina
Há muitos anos, os inibidores da enzima conversora da angiotensina (IECA) têm sido usados para tratar hipertensão e IC. O uso da IECA está associado à melhora da função muscular esquelética. Os IECA são uma das terapias fundamentais na IC, e seu efeito sobre a sarcopenia pode estar relacionado ao tratamento da síndrome subjacente. No entanto, os IECA também pode produzir seus efeitos benéficos através da melhoria da função endotelial, efeitos anti-infamatórios e angiogênese, aumentando assim o fluxo sanguíneo do músculo esquelético.
Os IECA podem potencialmente aumentar os níveis de IGF-1 e melhorar a função mitocondrial, reduzindo o catabolismo muscular. Portanto, há um racional biológico para o potencial dos IECA em retardar o desenvolvimento ou a progressão da sarcopenia.
Um estudo observacional mostrou que o uso contínuo de IECA por 3 anos foi associado a uma menor taxa de declínio na força muscular e velocidade de caminhada entre idosas hipertensas quando comparado ao uso intermitente de IECA ou outros medicamentos anti-hipertensivos.
4. LACUNAS NO CONHECIMENTO
Há uma necessidade inédita de padronizar as definições de sarcopenia (e conceitos clínicos relacionados à massa, qualidade e função muscular). As ferramentas utilizadas para diagnosticar a sarcopenia na prática necessitam de maiores investigações, com foco em instrumentos diagnósticos confiáveis e reprodutíveis, incluindo o uso de pontos de corte padronizados para exames de imagem e biomarcadores que avaliem a musculatura esquelética, especialmente no contexto da obesidade (ou seja, para a obesidade sarcopênica).
Dado que a sarcopenia geralmente ocorre no contexto de danos/falência de órgãos-alvo, inflamação crônica, má nutrição e imobilidade prolongada, biomarcadores que integram multi "ômica" podem ser úteis para detecção e avaliações longitudinais da sarcopenia.
Um grupo de trabalho do estudo TAME (Targeting Aging With Metformin) recomendou o seguinte: IL-6, receptor de TNF-α I ou II, PCR, GDF15, insulina, IGF-1, cys-tatin C, NT-proBNP (peptídeo natriurético tipo B N-terminal) e hemoglobina A1c, mas também observou uma escassez de evidências para biomarcadores em estudos em humanos refletindo processos de envelhecimento.
O exame de proteínas mitocondriais específicas, que podem desempenhar um papel na fisiopatologia da sarcopenia, também poderia ser uma área frutífera para futuras investigações. Trabalhos futuros usando abordagens de "big data" baseadas em ômica poderiam identificar combinações de biomarcadores fortemente associados à massa e função muscular, prognóstico e resposta ao tratamento.
O estudo da variabilidade clínica da qualidade e função muscular entre diferentes grupos étnicos em risco ou vivendo com DCV é necessário e pode fornecer informações mecanicistas sobre o desenvolvimento e a progressão da sarcopenia entre as populações mais vulneráveis.
Além disso, precisamos de estudos rigorosos de intervenções que possam prevenir ou impedir o desenvolvimento ou a progressão. Isso deve incluir uma avaliação de programas estruturados de exercícios resistidos com ou sem suplementação nutricional. É igualmente necessário avaliar a melhor forma de aproveitar a infraestrutura de reabilitação para satisfazer as necessidades dos adultos com DCV.
Finalmente, a pesquisa é necessária para examinar a eficácia e a segurança de estratégias farmacoterapêuticas visando substratos-chave da sarcopenia, com atenção dada à mioesteatose, particularmente importante no desenvolvimento da obesidade sarcopênica.
5. FONTE:
1. Circulation 2023;147:1534–1553.
2. Journal of Cachexia, Sarcopenia and Muscle 2020; 11:1429–1446.





Nenhum comentário:
Postar um comentário